Фтористый водород класс опасности
ВОДОРОД ФТОРИСТЫЙ БЕЗВОДНЫЙ № ООН 1052


Максимальное количество нетто на внутреннюю тару
(в граммах для твердых веществ и в мл для жидкостей и газов)
Максимальное количество нетто на наружную тару
(в граммах для твердых веществ и в мл для жидкостей и газов либо сумма граммов и мл в случае смешанной упаковки)
Не допускаются в качестве освобожденного количества






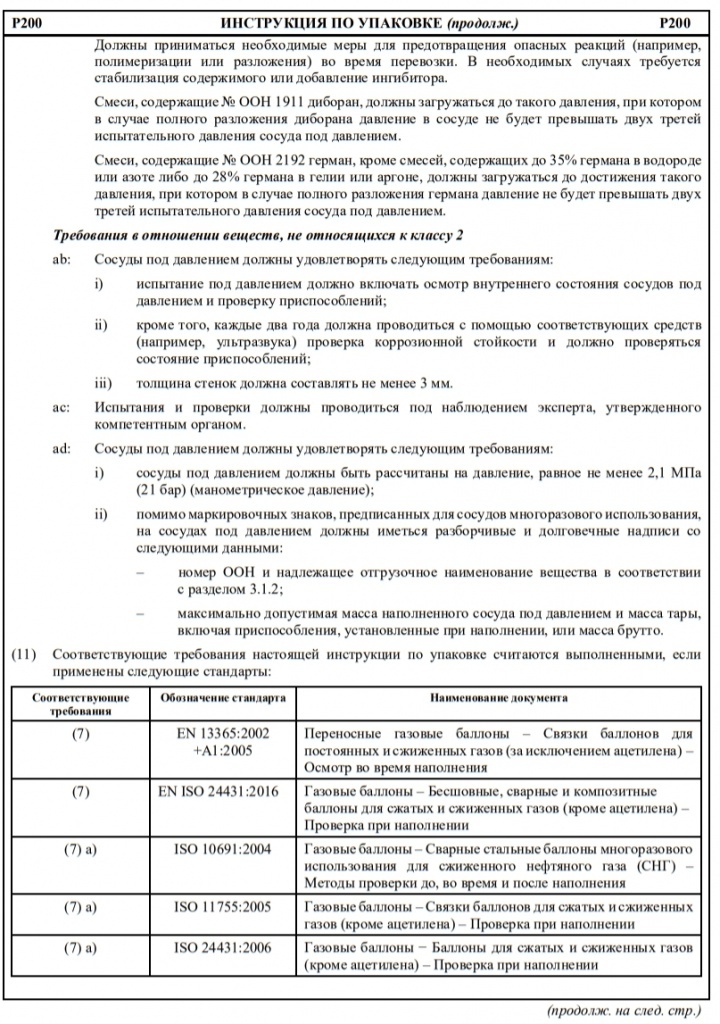






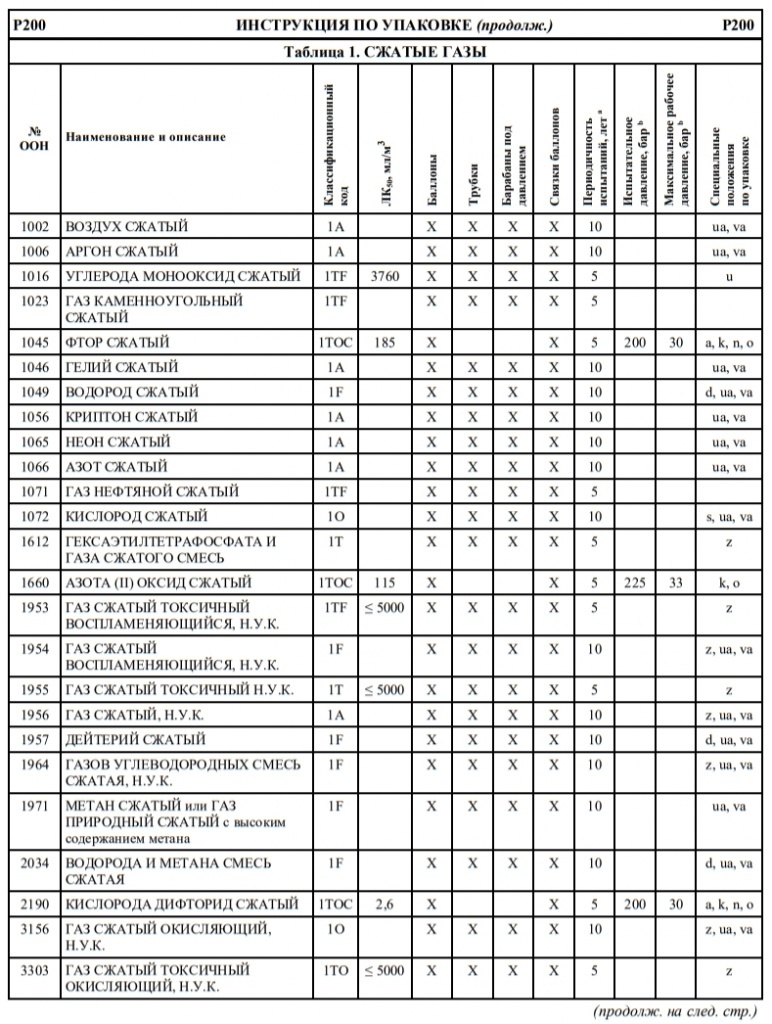
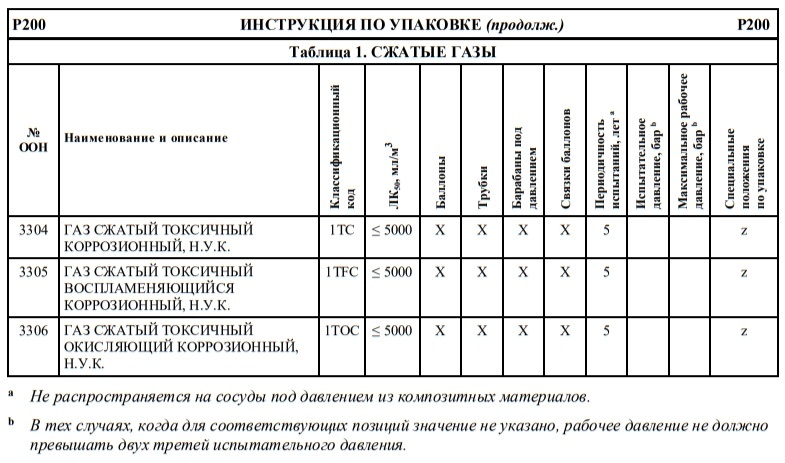
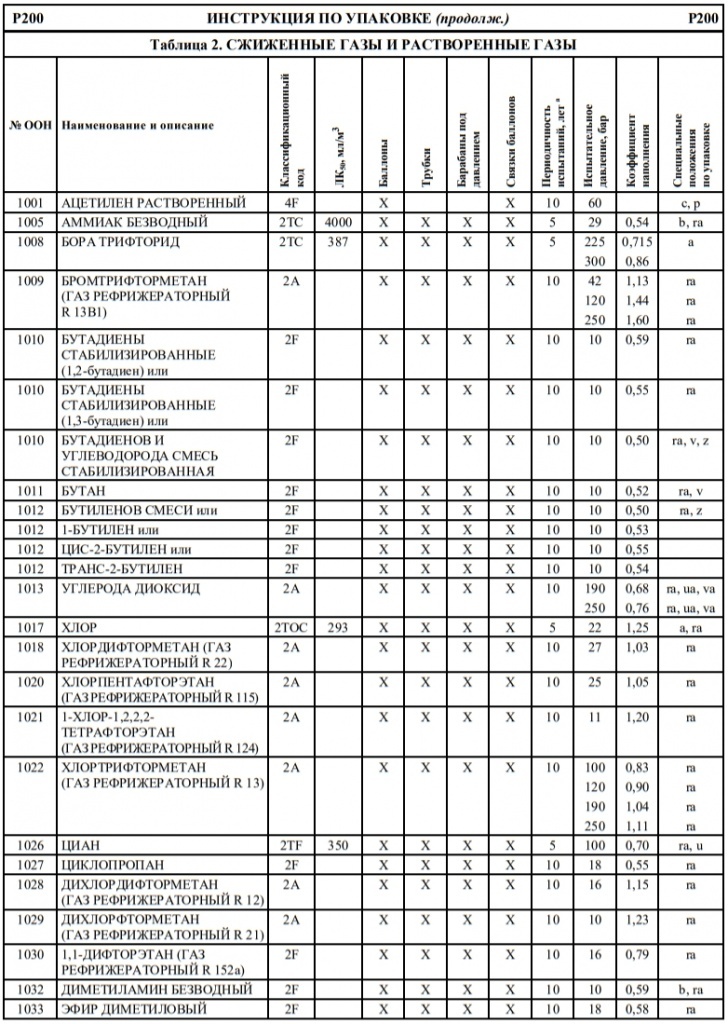
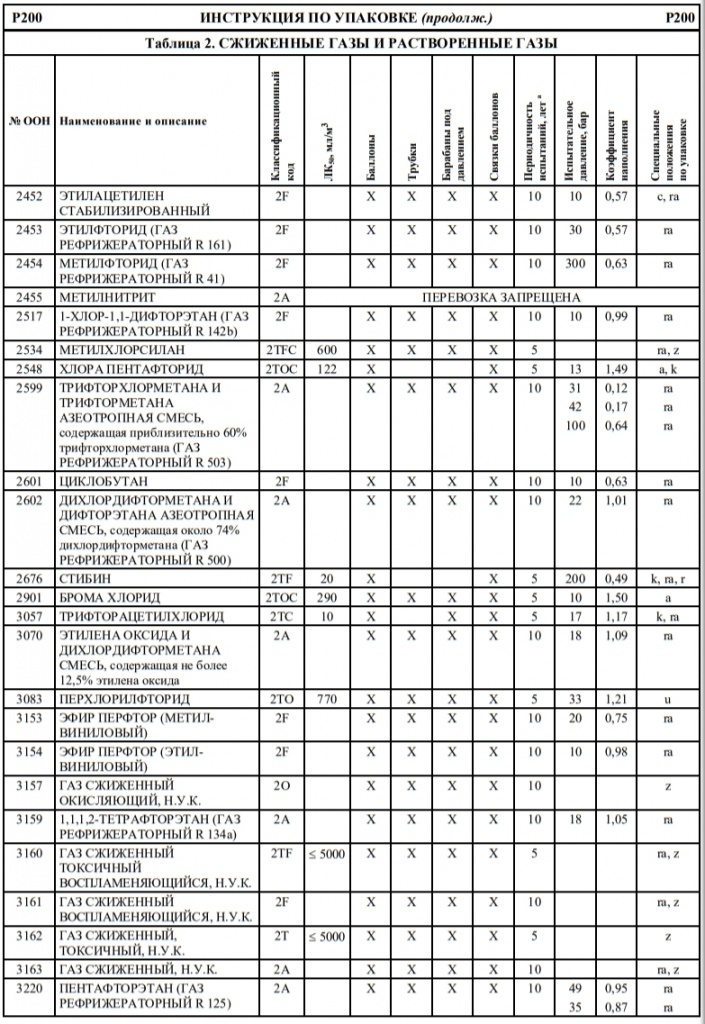
Если в колонке 10 таблицы A главы 3.2 для того или иного опасного груза указана какая-либо конкретная инструкция по переносным цистернам, то могут использоваться и другие переносные цистерны, которым предписаны более высокое минимальное испытательное давление и бóльшая толщина корпуса, а также более жесткие требования в отношении дoнных отверстий и устройств для сброса давления. Для определения надлежащих переносных цистерн, которые могут использоваться для перевозки отдельных веществ, необходимо руководствоваться следующими принципами:
Другие инструкции по переносным цистернам, которые разрешается применять
T2, T3, T4, T5, T6, T7, T8, T9, T10, T11, T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T4, T5, T7, T8, T9, T10, T11, T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T4, T5, T6, T7, T8, T9, T10, T11, T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T5, T7, T8, T9, T10, T11, T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T10, T14, T19, T20, T22
T7, T8, T9, T10, T11, T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T8, T9, T10, T11, T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T9, T10, T13, T14, T19, T20, T21, T22
T10, T13, T14, T19, T20, T21, T22
T14, T19, T20, T22
T12, T13, T14, T15, T16, T17, T18, T19, T20, T21, T22
T14, T16, T18, T19, T20, T22
T14, T19, T20, T21, T22
T16, T17, T18, T19, T20, T21, T22
T18, T19, T20, T22
T18, T19, T20, T21, T22
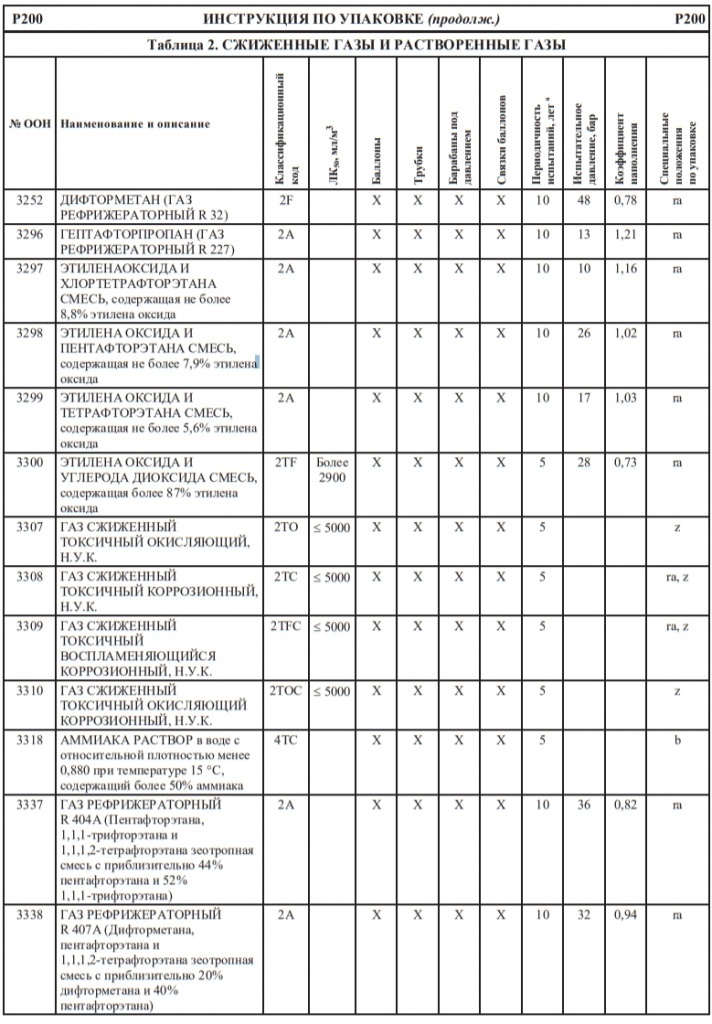
Кодирование цистерн. Четыре части кодов (кодов цистерн), указанных в колонке 12 таблицы А главы 3.2, имеют следующие значения:
| Часть | Описание | Код цистерны |
| 1 | Типы цистерн | L = цистерна для веществ в жидком состоянии (жидкостей или твердых веществ, предъявляемых к перевозке в расплавленном состоянии); S = цистерна для веществ в твердом состоянии (порошкообразных или гранулированных). |
| 2 | Расчетное давление | G = минимальное расчетное давление в соответствии с общими требованиями пункта 6.8.2.1.14; или 1,5; 2,65; 4; 10; 15 или 21 = минимальное расчетное давление в барах (см. пункт 6.8.2.1.14). |
| 3 | Отверстия (см. пункт 6.8.2.2.2) | A = цистерна с отверстиями для наполнения снизу или опорожнения снизу, с двумя затворами; B = цистерна с отверстиями для наполнения снизу или опорожнения снизу, с тремя затворами; C = цистерна с отверстиями для наполнения и опорожнения сверху, имеющая ниже уровня жидкости только отверстия для очистки; D = цистерна с отверстиями для наполнения и опорожнения сверху, не имеющая отверстий, расположенных ниже уровня жидкости. |
| 4 | Предохранительные клапаны/устройства | V = цистерна с дыхательным устройством согласно пункту 6.8.2.2.6, но без устройства, предотвращающего распространение пламени; или цистерна, не устойчивая к ударному давлению взрыва; F = цистерна с дыхательным устройством согласно пункту 6.8.2.2.6, оснащенным устройством, предотвращающим от распространения пламени; или цистерна, устойчивая к ударному давлению взрыва; N = цистерна, не имеющая дыхательного устройства согласно пункту 6.8.2.2.6 и не являющаяся герметически закрытой; H = герметически закрытая цистерна (см. раздел 1.2.1). |
| Код цистерны | Группа допущенных веществ | ||
| Класс | Классификационный код | Группа упаковки | |
| L21DH | 4.2 | S1 | I |
| S3 | I | ||
| SW | I | ||
| ST3 | I | ||
| а также группы веществ, допущенных к перевозке в цистернах под кодами LGAV, LGBV, LGBF, L1,5BN, L4BN, L4BH, L4DH, L10BH, L10CH, L10DH и L15CH | |||
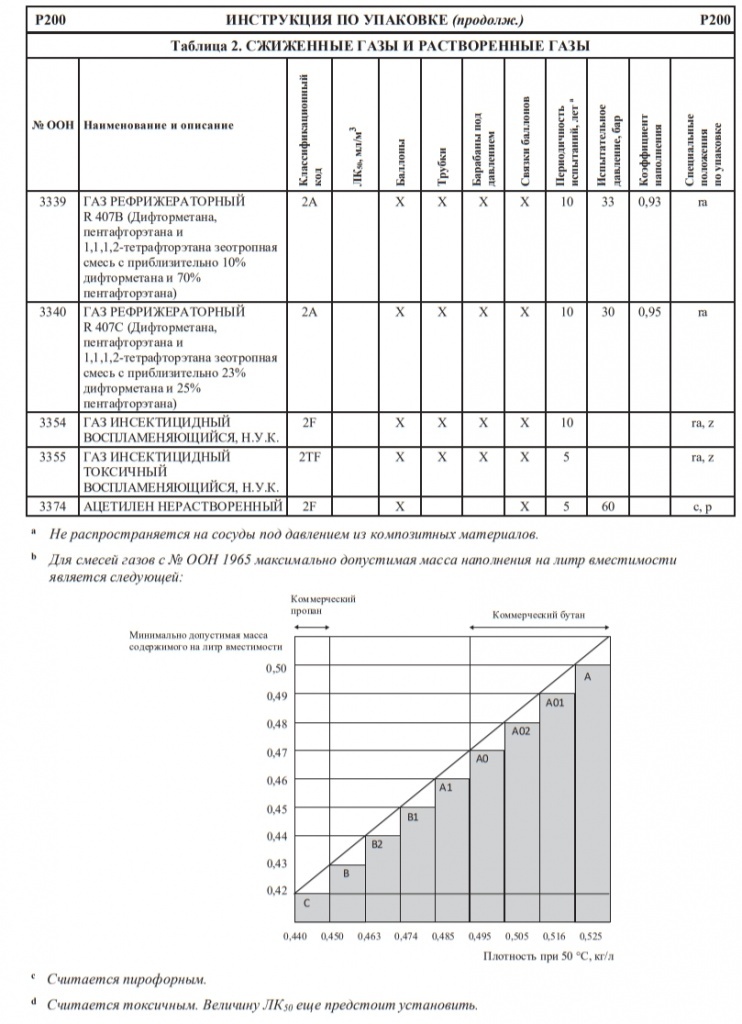
Цистерны с кодами, отличными от тех, которые указаны в этой таблице или в таблице А главы 3.2, могут также использоваться при условии, что каждый элемент (цифра или буква) частей 1–4 этих кодов цистерн соответствует уровню безопасности, по меньшей мере эквивалентному соответствующему элементу кода, указанного в таблице А главы 3.2, согласно следующей возрастающей последовательности:
Примеры: – цистерну с кодом L10CN разрешается использовать для перевозки вещества, которому присвоен код цистерны L4BN; – цистерну с кодом L4BN разрешается использовать для перевозки вещества, которому присвоен код цистерны SGAN7
Часть 1: Типы цистерн
S → L
Часть 2: Расчетное давление
G → 1.5 → 2,65 → 4 → 10 → 15 → 21 бар
Часть 3: Отверстия
A → B → C → D
Часть 4: Предохранительные клапаны/устройства
V → F → N → H.
Примеры:
– цистерну с кодом L10CN разрешается использовать для перевозки вещества,
которому присвоен код цистерны L4BN;
– цистерну с кодом L4BN разрешается использовать для перевозки вещества,
которому присвоен код цистерны SGAN7
ПРИМЕЧАНИЕ: В этой иерархии не учтены какие-либо специальные положения для каждой позиции (см. разделы 4.3.5 и 6.8.4).
Для тех случаев, когда опасные грузы, перевозимые в транспортной единице, относятся к одной и той же категории, в колонке 3 приведенной ниже таблицы указано максимальное общее количество на транспортную единицу.
Влияние фторида водорода на организм человека. Водный раствор фтороводорода

Фтороводород (HF) — негорючее бесцветное вещество с резким раздражающим запахом, дымит на воздухе. Попадая в организм человека, оказывает токсичное воздействие. В реакции с соединениями может вызвать пожар или взрыв. Растворяясь в воде, образует фтороводородную кислоту.
Образование HF может быть связано со взрывом при взаимосвязи с водородом, в процессе взаимодействия плавикового шпата и сильных нелетучих кислот. Процедура выполняется в печах из стали при 120-300 градусах C, и занимает много времени. Установочные части, предназначенные для вбирания HF, производятся из свинца.
Водный раствор фтороводорода
В сжиженном виде фтористый водород представляет собой плавиковую кислоту, и применяется как 40-72 %-ный раствор. В ней могут содержаться примеси железа, мышьяка, сернистого газа. Концентрация 60 % раствора участвует в химии органического синтеза. Хранение смеси производится в полиэтиленовых или тефлоновых сосудах, а многотоннажная плавиковая кислота транспортируется в резервуарах из стали. Применяется при производстве кремнефторидов, синтетических смазочных масел и борфторида аммония, который служит компонентом флюсов в металлургии. Используется при электролизе для получения чистого бора, цементов и эмалей, не восприимчивых к минеральным кислотам. Флюаты обеспечивают водонепроницаемость стройматериалов. Большую значимость имеет раствор в матировании стекла и полупроводниковой индустрии, участвуя в травлении кремния. Используется для получения криолита, фтористых производных урана, фреонов. При добавлении в примесь акцепторов фтора образуются сверхкислые среды. В нефтехимической промышленности раствор необходим для обработки и очистки поверхностей. Применяется в призабойных зонах добывающих скважин. В сочетании с прочими кислотами счищает со стенок аппаратуры отложения асфальтов и парафинов, что увеличивает эффективность нефтедобычи. Присутствует в системах фильтрации.
Влияние фторида водорода на человека
Вещество ядовито и представляет большую опасность для человека, как в состоянии газа, так и виде жидкости. Плавиковая кислота оказывает наркотическое воздействие, и пагубно сказывается на работе сердечно-сосудистой, выделительной, дыхательной системы, поражает кожные покровы и слизистые оболочки. Отравление смесью через кожные покровы протекает безболезненно, симптомы проявляются на следующий день: образование язв на участках кожи и ожогов на слизистой глаз. Попадание в организм путем вдыхания, влечет за собой разрушение тканей легких. При острой интоксикации первой помощью является 2 % раствор СаСЬ. При ожогах пострадавшую область необходимо долгое время промывать под струей холодной воды, после чего наложить компресс 20 %-ной взвеси MgO в глицерине.
Обеспечение безопасности при работе с HF
В промышленном производстве возможны утечки высокотоксичного вещества FH, поэтому должна проводиться постоянная проверка концентрации фтороводорода в рабочем помещении. ПДК на заводских объектах с барабанными печами, составляет 0, 1 мг/м3. Для контроля содержания ядовитого газа в воздухе на предприятиях должно быть установлено специальное газоаналитическое оборудование, наиболее востребованное на рынке КИПиА: Vector , Бинар-1П , ИГМ-13 , Лидер 021 , Лидер 041 , Микросенс М3 , ПГУ-А , ССС-903МТ , ССС-903МЕ , Хоббит-Т переносной , Эколаб , ОКА-92МТ . Данные приборы вовремя оповестят персонал о превышении допустимого порога концентрации примеси, что поможет избежать отравления сотрудников, а также исключит вероятность взрывов и пожаров в здании.
Качественную и надежную аппаратуру можно приобрести в компании RTECO — проверенного поставщика КИПиА известных производителей.
Дополнительными средствами индивидуальной защиты от ядовитых примесей в воздухе являются респираторы, фильтрующие и изолирующие противогазы. Для защиты от химических и термических ожогов при работе со смесью нужно пользоваться шерстяной спецодеждой, резиновой обувью, перчатками и изолирующими очками. Несоблюдение перечисленных мер может привести к аварийной ситуации на производстве, интоксикации или смерти работников.
Фтористый водород
Фтористый водород
| Фтороводород | |
 |
|
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | фтороводород |
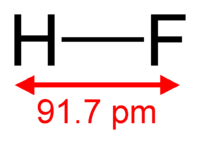
| Химическая формула | HF |
| Отн. молек. масса | 20.01 а. е. м. |
| Молярная масса | 20.01 г/моль |
| Физические свойства | |
| Плотность вещества | 0,99 г/см³ |
| Состояние (ст. усл.) | газ или подвижная жидкость |
| Термические свойства | |
| Температура плавления | -83.4 °C |
| Температура кипения | 19.54 °C |
| Энтальпия (ст. усл.) | -273,3 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 72,47 (20°C) г/100 мл |
| Классификация | |
| номер CAS | 7664-39-3 |
Фтороводород — бесцветный газ с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная жидкость. Хорошо растворим в воде в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует азеотропную смесь с концентрацией 35,4% HF.
Содержание
Строение молекулы
Молекула фотороводорода сильно полярна, μ = 0,64·10 -29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FН приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии, фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствии высокой прочности связи, термический распад фотороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама,самого тугоплавкого из металлов,для сравнения, у воды термический распад становится заметным при температуры выше 2000 °C).
- Ахметов Н.С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия 1994
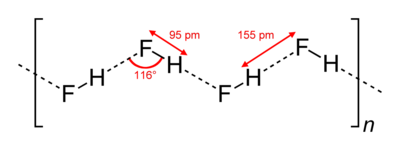
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Свойства
Физические свойства
- Критическая температура фтористого водорода 188 °C, критическое давление 64 атм.
- Теплота испарения жидкого НF в точке кипения составляет лишь 7,5 кДж/моль (примерно в 6 раз меньше, чем у воды при 20 °C). Это обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (димерная форма, характерная для жидкости, сохраняется и в парах — в отличие от фазового перехода воды).
- Диэлектрическая проницаемость жидкого фтористого водорода (84 при 0 °C) очень близка к значению д.п. для воды.
Химические свойства
- Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с окисдами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
МО + 2HF = MF2 + Н2О
- Жидкий HF – сильный ионизирующий растворитель. Все электролиты, растворенные в нем, за исключением хлорной кислоты НClO4, являются основаниями:
HCl + 2HF ↔ ClH2 + + HF2 — В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид ионов, например BF3, SbF5: BF3 + 2HF → FH2 + + BF4 — Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома (III): 3NaF + AlF3 → 3Na + + AlF6 — (AlF3 — как кислота) AlF3 + 3BF3 → Al 3+ + 3BF4 — (AlF3 — как основание)
- Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
HF + H2O ↔ OH3 + + HF2 — Kd= 7.2·10 — 4 HF + F — ↔ HF2 — Kd= 5.1 В водном растворе HF (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их трудно растворимо в воде, хорошо растворяются лишь фториды Na, К, Ag, Al, Sn и Hg. Все соли плавиковой кислоты ядовиты.
Получение
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных кислот (например, серной):
Процесс проводят в стальных печах при 120–300°С. Части установки, служащие для поглощения HF, делаются из свинца.
Техника безопасности
Очень ядовит! Фтористый водород (гидрофторид) обладает резким запахом, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей.
Подробнее о токсикологии фтороводорода см в ст. Плавиковая кислота.
Применение
Применяют для получения криолита, фтористых производных урана, фреонов, фторорганических веществ, матового травления силикатного стекла (плавиковую кислоту — для прозрачного травления).
Любопытные факты
Известный писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.
Литература
- Ахметов Н.С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия 1994
Wikimedia Foundation . 2010 .
- Фторид урана (VI)
- Фтористоводородная кислота
Смотреть что такое «Фтористый водород» в других словарях:
ФТОРИСТЫЙ ВОДОРОД — HF, бесцветная, легкоподвижная, дымящая на воздухе жидкость с резким запахом; плотность 0,98 г/см³ (при 12 .С), tпл ?83,36 .С, tкип 19,52 .С. С водой смешивается во всех соотношениях, образуя фтористоводородную кислоту. Применяют в… … Большой Энциклопедический словарь
фтористый водород — то же, что фтороводород. * * * ФТОРИСТЫЙ ВОДОРОД ФТОРИСТЫЙ ВОДОРОД, HF, бесцветная, легкоподвижная, дымящая на воздухе жидкость с резким запахом; плотность 0,98 г/см3 (при 12 °С), tпл 83,36 °С, tкип 19,52 °С. С водой смешивается во всех… … Энциклопедический словарь
Фтористый водород — HF, соединение фтора с водородом. Плотность 0,98 г/см3 (12°С), tпл 83,37°С, tkип 19,43°С. Выше 19,43°С бесцветный газ с резким запахом, раздражающим дыхательные пути, ниже этой температуры бесцветная легкоподвижная жидкость; tkpит 230,2°С … Большая советская энциклопедия
Фтористый водород — Фтористо водородная кислота (см. Фтор) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ФТОРИСТЫЙ ВОДОРОД — HF, бесцв. газ или подвижная жидкость, дымящая на воздухе; т. пл. 83,36 0C, т. кип. 19,520C; t крит230 0C, d крит 0,29 г/см 3, р крит 6,49 МПа; 29,14 Дж/(моль … Химическая энциклопедия
ФТОРИСТЫЙ ВОДОРОД — HF бесцветная легкоподвижная жидкость, сильно дымящая на воздухе; имеет низкую tnл ( 83,36 °С). Плотн. жидкого Ф. в. 991 кг/м3 (при tкип 19,52 °С). Неограниченно растворим в воде с образованием фтористоводородной к ты. Взаимодействует со мн. хим … Большой энциклопедический политехнический словарь
ФТОРИСТЫЙ ВОДОРОД — то же, что фтороводород … Естествознание. Энциклопедический словарь
фтористый водород — фтороводород … Cловарь химических синонимов I
ФТОРИСТЫЙ — ФТОРИСТЫЙ, фтористая, фтористое (хим.). Содержащий в себе фтор. Фтористый водород. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Водород — 6. Водород По ГОСТ 3022 и ГОСТ 14022 Источник: ГОСТ 21957 76: Техника криогенная. Термины и определения … Словарь-справочник терминов нормативно-технической документации
Справочник аналитика : ПДК воздуха населенных мест
Предельно допустимые концентрации (ПДК) загрязняющих веществ в воздухе населенных мест
Аммофос (смесь моно- и диам-
0. 0-Ди метил-(1-гидрокси-2, 2,
2, 6-Диметилфенол (2, 6-ксиле-
Диморфолиндисульфид (N, N’-
Динил (смесь 25 % дифенила и
2, З-Дихлор-1. 4-нафтахинон
0. 6-Диэтил S-(6-хлорбензоксазо-
Железа сульфат 1 (в пересчете на
Железа хлорид 1 (в пересчете
Кадмия нитрат (в пересчете на
Кадмия сульфат (в пересчете
Нитрилы карбоновых кислот
Пыль неорганическая с содержанием диоксида кремния (%): выше 70 (динас и др.)
Смола легкая высокоскоростного пиролиза бурых углей
по органическому углероду
Примечания: 1. При совместном присутствии в атмосферном воздухе нескольких веществ, обладающих суммацией действия, сумма их концентраций не должна превышать единицы при расчете по формуле:

где r 1 , r 2 , . r — фактические концентрации веществ в атмосферном воздухе;
ПДК 1 , ПДК 2 , . ПДК-предельно допустимые концентрации тех же веществ.
Эффектом суммации обладают:
1. Аммиак и сероводород;
2. Аммиак, сероводород и формальдегид;
3. Аммиак и формальдегид;
4. Азота диоксид и оксид, мазутная зола, серы диоксид;
5. Азота диоксид, гексан, углерода оксид, формальдегид;
6. Азота диоксид, гсксен, серы диоксид, углерода оксид;
7. Азота диоксид, серы диоксид;
8. Азота диоксид, серы диоксид, углерода оксид, фенол;
9. Ацетон, акролеин, фталевый ангидрид;
10. Ацетон и фенол;
11. Ацетон и ацетофенон;
12. Ацетон, фурфурол, формальдегид и фенол;
13. Ацетальдегид и винилацетат;
14. Аэрозоли ванадия (V) оксида и оксидов марганца;
15. Аэрозоли ванадия (V) оксида и диоксида серы;
16. Аэрозоли оксидов ванадия (V) и хрома (VI);
17. Бензол и ацетофенон;
18. Валериановая, капроновая и масляная кислоты;
19. Вольфрама (VI) оксид и серы диоксид;
20. Гексахлоран и фозалон;
21. 2, 3-Дихлор-1,4-нафтахинон и 1,4-нафтахинон;
22. 1, 2-Дихлорпропан, 1, 2, 3-трихлорпропан и тетрахлорэтилен;
23. Изопропилбензол и гидропероксид изопропилбензола;
24. Изобутилкарбинол и диметилвинилкарбинол;
25. Метилгидропиран и метилентетрагидропиран;
26. Мышьяковистый ангидрид и свинца ацетат;
27. Мышьяковистый ангидрид и германий;
28. Озон, диоксид азота и формальдегид;
29. Пропионовая кислота и пропионовый альдегид;
30. Свинца оксид, серы диоксид;
31. Сероводород, формальдегид;
32. Сернокислые медь, кобальт, никель и серы диоксид;
33. Серы диоксид, окись углерода, фенол и пыль конверторного производства’
34. Серы диоксид и фенол;
35. Серы диоксид и фтористый водород;
36. Серы диоксид и триоксид серы, аммиак и оксиды азота;
37. Сероводород и динил;
38. Сильные минеральные кислоты (серная, соляная и азотная);
39. Углерода оксид и пыль цементного производства;
40. Уксусная кислота и уксусный ангидрид;
41. Фенол и ацетофенон;
42. Фурфурол, метиловый и этиловый спирты:
43. Циклогексан и бензол;
44. Этилен, пропилен, бутилен и амилен.
II. При совместном присутствии эффектом неполной суммации обладают:
1. Вольфрамат натрия, парамолибдат аммония, свинца ацетат (коэффициент комбинированного действия К кд равен 1,6);
2. Вольфрамат натрии, мышьяковистый ангидрид, парамолибдат аммония, свинца ацетат ( К кд = 2,0);
3. Вольфрамат натрия, германия диоксид, мышьяковистый ангидрид, парамолибдат аммония, свинца ацетат ( К кд = 2,5).
III. При совместном присутствии сохраняются ПДК каждого вещества
при изолированном воздействии:
1. Гексиловый, октиловый спирты;
2. Серы диоксид, цинка оксид.
IV. Эффектом потенцирования обладают:
1. Бутилакрилат и метилметакрилат с коэффициентом 0,8;
2. Фтористый водород и соли фторсодержащих кислот с коэффициентом 0,8.
Технические и торговые названия некоторых веществ
(цифры — порядковый номер в списке ПДК)
Фтористый водород — Hydrogen fluoride



- 7664-39-3
 Y
Y
- ЧЕБИ: 29228
 Y
Y
- 14214
 Y
Y
- C16487
 Y
Y
- MW7875000
- RGL5YE86CZ
 Y
Y

Фтористый водород — это химическое соединение с химической формулой H F . Этот бесцветный газ или жидкость является основным промышленным источником фтора , часто в виде водного раствора, называемого плавиковой кислотой . Он является важным сырьем для получения многих важных соединений, включая фармацевтические препараты и полимеры, например политетрафторэтилен (тефлон). HF широко используется в нефтехимической промышленности как компонент суперкислот . Фтористый водород кипит около комнатной температуры, что намного выше, чем у других галогенидов водорода .
Фтористый водород — очень опасный газ, образующий коррозионную проникающую плавиковую кислоту при контакте с влагой. Газ также может вызвать слепоту из-за быстрого разрушения роговицы .
Содержание
- 1 История
- 2 Строение и реакции
- 2.1 Сравнение с другими галогенидами водорода
- 2.2 Водные растворы
- 2.3 Реакции с кислотами Льюиса
- 3 Производство
- 4 Использование
- 4.1 Прекурсор фторорганических соединений
- 4.2 Прекурсор фторидов металлов и фтора
- 4.3 Катализатор
- 4.4 Растворитель
- 5 Влияние на здоровье
- 6 Ссылки
- 7 Внешние ссылки
История
В 1771 году Карл Вильгельм Шееле приготовил водный раствор плавиковой кислоты в больших количествах, хотя фтористоводородная кислота была известна в стекольной промышленности до этого. Французскому химику Эдмонду Фреми (1814–1894) приписывают открытие безводного фтористого водорода (HF) при попытке выделить фтор .
Структура и реакции

Хотя HF является двухатомной молекулой, он образует относительно прочные межмолекулярные водородные связи . Твердый HF состоит из зигзагообразных цепочек молекул HF. Молекулы HF с короткой связью H – F 95 пм связаны с соседними молекулами межмолекулярными расстояниями H – F 155 пм. Жидкий HF также состоит из цепочек молекул HF, но цепи короче и состоят в среднем всего из пяти-шести молекул.
Сравнение с другими галогенидами водорода
Фтористый водород не кипит до 20 ° C, в отличие от более тяжелых галогенидов водорода, которые кипят между -85 ° C (-120 ° F) и -35 ° C (-30 ° F). Эта водородная связь между молекулами HF приводит к высокой вязкости в жидкой фазе и более низкому, чем ожидалось, давлению в газовой фазе.
Водные растворы
HF смешивается с водой (растворяется в любых пропорциях). Напротив, другие галогениды водорода проявляют ограниченную растворимость в воде. Фтористый водород образует моногидрат HF . H 2 O с т.пл. -40 ° C (-40 ° F), что на 44 ° C (79 ° F) выше точки плавления чистого HF.
| HF и H 2 O сходства | |
 |
 |
| Температуры кипения галогенидов водорода (синий) и халькогенидов водорода (красный): HF и H 2 O изменяют тенденции. | Температура замерзания смесей HF / H 2 O: стрелки указывают соединения в твердом состоянии. |
Водные растворы HF называются плавиковой кислотой . В разбавленном состоянии фтористоводородная кислота ведет себя как слабая кислота, в отличие от других галогеноводородных кислот, из-за образования ионных пар с водородными связями [ H
3 О +
· F — ]. Однако концентрированные растворы являются сильными кислотами, потому что преобладают анионы бифторида , а не ионные пары. В жидком безводном HF происходит самоионизация :
который образует чрезвычайно кислую жидкость ( H 0 = -11).
Реакции с кислотами Льюиса
Производство
Фтористый водород получают действием серной кислоты на чистые сорта минерального флюорита :
Около 20% производимого HF является побочным продуктом производства удобрений, при котором образуется гексафторкремниевая кислота . Эта кислота может быть разложена с выделением HF термически и путем гидролиза:
Использовать
В общем, безводный фтористый водород является более распространенным в промышленности, чем его водный раствор, фтористоводородная кислота . Его основное применение в тоннах — это прекурсор фторорганических соединений и прекурсор криолита для электролиза алюминия.
Прекурсор фторорганических соединений
HF реагирует с хлороуглеродами с образованием фторуглеродов. Важным применением этой реакции является производство тетрафторэтилена (ТФЭ), предшественника тефлона . Хлороформ подвергают фторированию HF с образованием хлордифторметана (R-22):
CHCl 3 + 2 HF → CHClF 2 + 2 HCl
Пиролиз хлордифторметана (при 550-750 ° C) дает ТФЭ.
HF является реактивным растворителем при электрохимическом фторировании органических соединений. При таком подходе, КВ окисляются в присутствии углеводорода , и фтор замещает С-Н св зи с С-F облигациями . Таким образом получают перфторированные карбоновые кислоты и сульфоновые кислоты .
1,1-Дифторэтан получают путем добавления HF к ацетилену с использованием ртути в качестве катализатора.
Промежуточным продуктом в этом процессе является винилфторид или фторэтилен, мономерный предшественник поливинилфторида .
Прекурсор фторидов металлов и фтора
Электро извлечение алюминия основывается на электролизе фторида алюминия в расплавленном криолите. На тонну произведенного алюминия расходуется несколько килограммов HF. Другие фториды металлов производятся с использованием HF, включая гексафторид урана .
HF является предшественником элементарного фтора F 2 при электролизе раствора HF и бифторида калия . Бифторид калия необходим, потому что безводный HF не проводит электричество. Ежегодно производится несколько тысяч тонн F 2 .
Катализатор
HF служит катализатором в процессах алкилирования на нефтеперерабатывающих заводах. Он используется на большинстве установленных производств линейного алкилбензола в мире. Процесс включает дегидрирование н- парафинов до олефинов и последующую реакцию с бензолом с использованием HF в качестве катализатора. Например, в нефтеперерабатывающих заводах «алкилат», компонент с высоким октановым число бензина ( бензин ), генерируются в единицах алкилирования, которые сочетают в себе С 3 и С 4 олефинов и изо изобутан .
Растворитель
Фтороводород — отличный растворитель. Отражая способность HF участвовать в образовании водородных связей, даже белки и углеводы растворяются в HF и могут быть извлечены из него. Напротив, большинство нефторидных неорганических химикатов скорее реагируют с HF, чем растворяются.
Влияние на здоровье

При контакте с влагой, в том числе с тканями, фтористый водород немедленно превращается в плавиковую кислоту , которая является очень едкой и токсичной. Воздействие требует немедленной медицинской помощи. Это может вызвать слепоту из-за быстрого разрушения роговицы . Вдыхание фтороводорода в больших количествах или в сочетании с контактом с кожей может вызвать смерть от нерегулярного сердцебиения или скопления жидкости в легких.
 Y
Y