Фтористый водород код вещества
Водород фтористый (фтороводород)
Водород фтористый (Фтороводород) – это бесцветный газ или бесцветная жидкость с резким запахом. Негорючее. Многие реакции могут привести к пожару или взрыву. Вещество может всасываться в организм при вдыхании и через кожу, и через рот.

Аварийная карточка (АХОВ)
В случае пожара: охлаждать баллоны, обливая их водой, но НЕ допускать прямого контакта вещества с водой. Вести борьбу с огнем из укрытия. В случае возгорания в окрестностях разрешены все средства пожаротушения.
Провести эвакуацию из опасной зоны! Проконсультироваться со специалистом! Вентиляция.
При ликвидации аварий, связанных с выбросом (проливом) фтористого водорода необходимо изолировать опасную зону, удалить из нее людей, держаться с наветренной стороны. Непосредственно на месте аварии и в зонах заражения с высокими концентрациями на расстоянии до 500 м от места разлива работы проводят в изолирующих противогазах ИП-4М, ИП-5 (на химически связанном кислороде) или дыхательных аппаратах АСВ-2, ДАСВ (на сжатом воздухе), КИП-8, КИП-9 (на сжатом кислороде) и средствах защиты кожи (Л-1, ОЗК, КИХ-4, КИХ-5). На расстоянии более 500 м от очага, где концентрация резко понижается средства защиты кожи можно не использовать, а для защиты органов дыхания используют промышленные противогазы с коробками марок А, В, БКФ, МКФ, а также гражданские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш в комплекте с дополнительным патроном ДПГ-3.
Нейтрализуют фтористый водород следующими растворами:
– аммиачной водой – 10%-ным водным раствором аммиака (например,100 литров жидкого аммиака + 900 литров воды);
– 10%-ным водным раствором гашеной извести (100 кг. гашеной извести + 900 литров воды);
– известковым молоком, для чего одну весовую часть гашеной извести заливают тремя частями воды, тщательно перемешивают, затем сверху сливают известковый раствор (например, 100 кг. гашеной извести + 300 литров воды);
– 10%-ным водным раствором кальцинированной соды, для чего 1 весовую часть кальцинированной соды растворяют и перемешивают с 9 частями воды (например, 100 кг. кальцинированной соды + 900 литров воды).
При утечке газообразного (при температуре выше +19,5 0 С) фтористого водорода для погашения паров распыляют воду.
При разливе жидкого фтористого водорода место разлива ограждают земляным валом (кроме песка), заливают известковым молоком, аммиачной водой, раствором гашеной извести, кальцинированной соды, либо водой. Для обезвреживания 1 тонны жидкого фтористого водорода необходимо 35-40 тонн воды. Для нейтрализации 1 тонны жидкого фтористого водорода необходимо 20 тонн растворов.
Для распыления воды или растворов применяют поливомоечные и пожарные машины, авторазливочные станции (АЦ, ПМ-130, АРС-14, АРС-15), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
В зараженной зоне: обильное промывание водой глаз и лица, надевание противогаза, срочный вывод (вывоз) из очага.
После эвакуации из зараженной зоны: согревание, покой, обильное промывание глаз водой, обработка пораженных участков кожи водой, мыльным раствором, при затруднении дыхания тепло на область шеи, немедленная эвакуация в лечебное учреждение. Ингаляции кислорода не проводить. Прополоскать рот. НЕ вызывать рвоту. Полусидячее положение.
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
БЕСЦВЕТНЫЙ ГАЗ ИЛИ БЕСЦВЕТНАЯ ЖИДКОСТЬ С РЕЗКИМ ЗАПАХОМ.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Водный раствор является сильной кислотой, он бурно реагирует с основаниями и коррозионно-агрессивен. Реагирует бурно с многими соединениями с опасностью пожара и взрыва. При контакте с воздухом выделяет едкие пары, которые тяжелее воздуха и будут распространяться по земле. Агрессивно в отношении стекла и других кремнийсодержащих соединений.
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании и через кожу, и через рот.
РИСК ПРИ ВДЫХАНИИ:
При утечке содержимого очень быстро достигается опасная концентрация этого газа в воздухе.
ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ:
Разъедающее действие. Вещество оказывает разъедающее действие на глаза, кожу и дыхательные пути. Вдыхание этого газа может вызвать отек легких (см. Примечания). Вещество может оказывать действие на кальцемию, вызывая гипокальцемию, приводя к сердечной и почечной недостаточности. Воздействие на уровне, значительно превышающем OEL может вызвать смерть. Эффекты могут быть отсроченными. Показано медицинское наблюдение.
ВЛИЯНИЕ ДОЛГОВРЕМЕННОГО ИЛИ МНОГОКРАТНОГО ВОЗДЕЙСТВИЯ:
Вещество может вызывать флюороз
НАЛИЧИЕ
ВОДОРОДА ФТОРИСТОГО
ОПРЕДЕЛЯЮТ:
В воздухе промышленной зоны приборами химической разведки ВПХР, ППХР, ПХР-МВ с использованием индикаторной трубки ИТ–44 (розовая краска, порог чувствительности 0,005 мг/л. или 5 мг/м 3 ), аспираторами АМ-5, АМ-0055, АМ-0059, НП-3М с индикаторными трубками на фтористый водород, газосигнализатором ХОББИТ- F- (H F), газоопределителем промышленных химических выбросов ГПХВ-2 в диапазоне 1-1000 мг/м 3 .
На открытом пространстве – приборами СИП «КОРСАР-Х».
В закрытом помещении – СИП «ВЕГА-М»
ФИЗИЧЕСКИЕ СВОЙСТВА
ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ (ПДК)
Температура кипения: 20°C
Температура плавления: -83°C
Относительная плотность (вода = 1): 1.0
Растворимость в воде: хорошая
Относительная плотность пара (воздух = 1): 0.7
Предельно допустимая концентрация (ПДК) фтористого водорода в воздухе населенных пунктов: среднесуточная 0,005 мг/м 3 , максимальная разовая 0,02 мг/м 3 , в воздухе рабочей зоны производственных помещений 0,5 мг/м 3 , что в 2 раза меньше (ПДК) хлора в воздухе. Порог восприятия запаха фтористого водорода 0,03 мг/м 3 , порог раздражающего действия 8 мг/м 3 , при этом появляется кашель и приступы удушья. При концентрации 50 мг/м 3 возникает раздражение слизистых оболочек, слезо-слюнотечение, насморк, иногда рвота. Очень высокие концентрации в 1500 мг/м 3 приводят к спазмам дыхательных органов, и при воздействии в течение 5 минут наступает смерть. Максимально допустимая концентрация при применении промышленных и гражданских противогазов составляет 2000 мг/м 3 .
Водород фтористый: характеристики и применение


Среди соединений галогенов – элементов 7 группы главной подгруппы периодической системы химических элементов Д. И. Менделеева — большое практическое значение имеет водород фтористый. Наряду с другими галогеноводородами, он используется в различных отраслях народного хозяйства: для получения фторсодержащих пластмасс, плавиковой кислоты и её солей. В данной работе мы изучим строение молекулы, физические и химические свойства этого вещества и рассмотрим области его применения.
История открытия
В 17 веке К. Шванквард провел опыт с минералом плавиковым шпатом и сульфатной кислотой. Ученый обнаружил, что в процессе реакции выделяется газ, который начал разрушать пластинку из стекла, прикрывающую пробирку со смесью реагентов. Это газообразное соединение получило название фтористый водород.

Плавиковая кислота была получена в 19 столетии Гей-Люссаком из того же сырья: флюорита и серной кислоты. Ампер своими опытами доказал, что по строению молекулы HF аналогичен хлороводороду. Это касается также водных растворов этих галогеноводородов. Отличия касаются силы кислот: плавиковая – слабая, а хлоридная – сильная.
Физические свойства
Газ с химической формулой HF имеет резкий характерный запах, бесцветен, немного легче воздуха. В ряду галогеноводородов HI- HBr- HCl- температуры кипения и плавления меняются плавно, а при переходе к HF резко увеличиваются. Объяснение этого явления следующее: молекулярный водород фтористый образует ассоциаты (группы нейтральных частиц, между которыми возникают водородные связи). Чтобы разорвать их, требуется дополнительная энергия, поэтому температуры кипения и плавления увеличиваются. Согласно показателям плотности газа, в интервале, близком к температуре кипения (+19,5), фтороводород состоит из агрегатов со средним составом HF2. При нагревании выше 25 о С эти комплексы постепенно разлагаются, и при температуре около 90 о С водород фтористый состоит из молекул HF.
Как добывают фторгидрид
Способы получения вещества не в лабораторных условиях, о которых мы уже упоминали, а в промышленности, практически нечем между собой не отличаются: реагентами являются все тот же плавиковый шпат (флюорит) и сульфатная кислота.

Минерал, залежи которого расположены в Приморье, Забайкалье, Мексике, США, сначала обогащают методом флотации, а затем используют в технологическом процессе получения HF, который осуществляют в специальных стальных печах. В них загружают руду и смешивают с сульфатной кислотой. Обогащенная руда содержит 55-60 % флюорита. Стенки печи выложены свинцовыми листами, улавливающими фтористый водород. Его очищают в промывочной колонне, охлаждают, а затем конденсируют. Чтобы получить водород фтористый, используют вращающиеся печи, косвенно обогревающиеся электричеством. Массовая доля HF на выходе составляет приблизительно 0,98, но процесс имеет свои недостатки. Он достаточно длительный и требует большого расхода сульфатной кислоты.
Полярность молекул HF
Безводный фтористый водород состоит из частиц, имеющих способность связываться между собой и образовывать агрегаты. Объясняется это внутренним строением молекулы. Между атомами водорода и фтора возникает сильная химическая связь, называемая полярной ковалентной. Она представлена общей электронной парой, смещенной к более электроотрицательному атому фтора. Вследствие этого молекулы фторгидрида становятся полярными и имеют вид диполей.

Между ними возникают силы электростатического притяжения, что и приводит к появлению ассоциатов. Длина химической связи между атомами водорода и фтора составляет 92 нм, а её энергия равна 42 кДж/моль. Как в газообразном, так и в жидком состоянии вещество состоит из полимерной смеси вида H2F2, H4F4.
Химические свойства
Безводный фтористый водород имеет способность ко взаимодействию с солями карбонатной, силикатной, нитритной и сульфидной кислот. Проявляя окислительные свойства, HF восстанавливает вышеперечисленные соединения до углекислого газа, четырехфтористого кремния, сероводорода и оксидов азота. Водный 40 % раствор фтороводорода разрушает бетон, стекло, кожу, каучук, а также взаимодействует с некоторыми оксидами, например с Cu2O. В продуктах обнаруживается свободная медь, фторид меди и вода. Есть группа веществ, с которыми HF не реагирует, например, тяжелые металлы, а также магний, железо, алюминий, никель.

Водный раствор фтороводорода
Он имеет название плавиковая кислота и используется в виде 40 % и 72 % растворов. Водород фтористый, характеристика химических свойств которого зависит от его концентрации, неограниченно растворяется в воде. При этом выделяется тепло, что характеризует этот процесс как экзотермический. Являясь кислотой средней силы, водный раствор HF взаимодействует с металлами (реакция замещения). Образуются соли – фториды — и выделяется водород. Не реагируют с плавиковой кислотой пассивные металлы – платина и золото, а также свинец. Кислота пассивирует его, то есть образует на поверхности металла защитную пленку, состоящую из нерастворимого фторида свинца. Водный раствор HF может содержать примеси железа, мышьяка, диоксида серы, в этом случае он называется технической кислотой. Концентрированный 60 % раствор HF имеет важное значение в химии органического синтеза. Он хранится в полиэтиленовых или тефлоновых емкостях, а многотоннажная плавиковая кислота перевозится в стальных цистернах.
Роль плавиковой кислоты в народном хозяйстве
Раствор фтороводорода применяют для производства борфторида аммония, являющегося компонентом флюсов в черной и цветной металлургии. Также его используют в процессе электролиза для получения чистого бора. Плавиковая кислота применяется в производстве кремнефторидов, например, такого как Na2SiF6. Его используют для получения цементов и эмалей, устойчивых к действию минеральных кислот.

Флюаты придают строительным материалам водонепроницаемые свойства. В процессе их применения нужно соблюдать осторожность, так как все кремнефториды токсичны. Водный раствор HF используют также и в производстве синтетических смазочных масел. В отличие от минеральных, они сохраняют вязкость и образуют защитную пленку на поверхности рабочих частей: компрессоров, редукторов, подшипников как при высоких, так и при низких температурах. Большое значение имеет водный фтористый водород в травлении (матировании) стекла, а также в полупроводниковой промышленности, где он используется для травления кремния.
Фторсодержащие пластмассы
Наиболее востребованным из них является тефлон (фторопласт – 4). Он был открыт совершенно случайно. Химик-органик Рой Планкетт, занимавшийся синтезом фреонов, обнаружил в баллонах с газообразным четерыххлористым этиленом, хранящимся при аномально низкой температуре, не газ, а белый порошок, жирный на ощупь. Оказалось, что при высоком давлении и низкой температуре тетрафторэтилен полимеризовался.
Это реакция привела к образованию новой пластической массы. Впоследствии её назвали тефлоном. Он обладает исключительной тепло- и морозоустойчивостью. Тефлоновые покрытия с успехом применяют в пищевой, химической промышленности, при производстве посуды с антипригарными свойствами. Даже при 70 о С изделия из фторопласта – 4 не теряют свои свойства. Исключительной является высокая химическая инертность тефлона. Он не разрушается при контакте с агрессивными веществами – щелочами и кислотами. Это очень важно для оборудования, используемого в технологических процессах получения нитратной и сульфатной кислот, гидроксида аммония, едкого натра. Фторопласты могут содержать дополнительные компоненты – модификаторы, такие как стекловолокно или металлы, вследствие чего они меняют свои свойства, например, повышают термостойкость и износоустойчивость.
Диссоциация фтористого водорода
Ранее мы упоминали, что в молекулах HF образуется прочная ковалентная связь, кроме того, сами они способны объединяться в агрегаты, образовывая водородные связи. Именно поэтому фтороводород имеет низкую степень диссоциации и плохо расщепляется в водном растворе на ионы. Плавиковая кислота является более слабой, чем хлоридная или бромидная. Эти особенности её диссоциации объясняют существование стойких, кислых солей, тогда как ни хлоридная, ни йодная их не образует. Константа диссоциации водного раствора фтороводорода составляет 7х10 -4 , что подтверждает тот факт, что в её растворе находится большое количество недиссоциированных молекул и отмечается низкое содержание ионов водорода и фтора.
Чем опасен фторгидрид
Нужно отметить, что токсичным является как газообразный, так и жидкий фтористый водород. Код вещества – 0342. Плавиковая кислота обладает также и наркотическими свойствами. На её влиянии на организм человека мы остановимся чуть позже. В классификаторе это вещество, так же как и безводный фторгидрид, находится во втором классе опасности. Это объясняется, прежде всего, способностью соединений фтора легко воспламеняться. В частности, это свойство особенно проявляется у такого соединения, как газообразный водород фтористый, пожаровзрывоопасность которого особенно велика.

Зачем определяют уровень фтороводорода в воздухе
В промышленном производстве HF, получаемого из плавикового шпата и серной кислоты, возможны потери газообразного продукта, пары которого попадают в атмосферу. Напомним, что фтористый водород (класс опасности которого – второй) – вещество высокотоксичное и требует постоянного измерения его концентрации. В промышленных выбросах содержится большое количество вредных и потенциально опасных химических веществ, прежде всего оксидов азота и серы, сульфидов тяжелых металлов, а также газообразных галогеноводородов. Среди них большая доля приходится на фтористый водород, ПДК которого в атмосферном воздухе составляет 0,005 мг/м 3 в пересчете на фтор в сутки. Для заводских участков, где находятся барабанные печи, предельно допустимая концентрация (ПДК) должна составлять 0, 1 мг/м 3 .
Газоанализаторы фтористого водорода
Чтобы выяснить, какие вредные газы и в каком количестве попали в атмосферу, существуют специальные измерительные приборы. Для обнаружения паров HF используют фотоколориметрические газоанализаторы, в которых применяют как лампы накаливания, так и полупроводниковые светодиоды в качестве источников излучения, а фотодиоды и фототранзисторы играют роль фотоприемников. Определение фтористого водорода в атмосферном воздухе проводится еще и инфракрасными газоанализаторами. Они достаточно чувствительны. Молекулы HF поглощают длинноволновые излучения в интервале 1-15 мкм. Приборы, используемые для определения токсичных отходов в атмосферном воздухе и в рабочей зоне промышленных предприятий, фиксируют колебания концентрации HF как в пределах допустимой нормы, так и в единичных экстремальных случаях (техногенные катастрофы, нарушения технологических циклов вследствие повреждений электроснабжения и т. д.). Эти функции выполняют термокондуктометрические газоанализаторы фтористого водорода. Пром. выбросы они дифференцируют на основе зависимости теплопроводности HF от состава газообразной смеси.

Вредное влияние фторгидрида на организм человека
Как безводный фтороводород, так и плавиковая кислота, являющаяся его раствором в воде, относятся ко второму классу опасности. Особенно негативно эти соединения влияют на жизненно важные системы: сердечно-сосудистую, выделительную, дыхательную, а также кожу и слизистые оболочки. Проникновение вещества через кожу проходит незаметно и бессимптомно. Явления токсикоза могут проявиться на следующие сутки, причем они диагностируются лавинообразно, а именно: кожа изъязвляется, на поверхности слизистой глаз образуются ожоговые участки. Ткани легких разрушаются вследствие некротического поражения альвеол. Ионы фтора, попавшие в межклеточную жидкость, далее проникают в клетки и связывают в них частицы магния и кальция, входящие в состав нервной ткани, крови, а также почечных канальцев – структур нефронов. Поэтому особенно актуальным является тщательный контроль за содержанием газообразного фтороводорода и паров плавиковой кислоты в атмосфере.
Водород фтористый (Фтороводород)

Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Первое сражение при Булл-Ран

Первое сражение при реке Булл-Ран (англ. First Battle of Bull Run), также Первое сражение при Манассасе) — первое крупное сухопутное сражение Гражданской войны в США. Состоялось 21 июля 1861 года возле Манассаса (штат Виргиния). Федеральная армия под командованием генерала Ирвина Макдауэлла атаковала армию Конфедерации под командованием генералов Джонстона и Борегара, но была остановлена, а затем обращена в бегство. Федеральная армия ставила своей целью захват важного транспортного узла — Манассаса, а армия Борегара заняла оборону на рубеже небольшой реки Булл-Ран. 21 июля Макдауэлл отправил три дивизии в обход левого фланга противника; им удалось атаковать и отбросить несколько бригад конфедератов. Через несколько часов Макдауэлл отправил вперёд две артиллерийские батареи и несколько пехотных полков, но южане встретили их на холме Генри и отбили все атаки. Федеральная армия потеряла в этих боях 11 орудий, и, надеясь их отбить, командование посылало в бой полк за полком, пока не были израсходованы все резервы. Между тем на поле боя подошли свежие бригады армии Юга и заставили отступить последний резерв северян — бригаду Ховарда. Отступление Ховарда инициировало общий отход всей федеральной армии, который превратился в беспорядочное бегство. Южане смогли выделить для преследования всего несколько полков, поэтому им не удалось нанести противнику существенного урона.
Из Википедии — свободной энциклопедии
Не следует путать с Hf.
Фтороводоро́д (фтористый водород, гидрофторид, фторид водорода, HF) — бесцветный токсичный газ (при стандартных условиях) с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF.
Строение молекулы
Молекула фтороводорода сильно полярна, μ = 0,64⋅10−29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
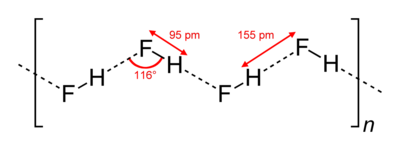
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
«Хлеб» (укр. «Хліб») — одна из наиболее известных картин украинской советской художницы Татьяны Яблонской, созданная в 1949 году, за которую ей в 1950 году была присуждена Сталинская премия II степени. Картина также была награждена бронзовой медалью Всемирной выставки 1958 года в Брюсселе, она экспонировалась на многих крупных международных выставках.
В работе над полотном художница использовала наброски, сделанные летом 1948 года в одном из наиболее благополучных колхозов Советской Украины — колхозе имени В. И. Ленина Чемеровецкого района Каменец-Подольской области, в котором в то время было одиннадцать Героев Социалистического Труда. Яблонская была восхищена масштабами сельскохозяйственных работ и людьми, которые там трудились. Советские искусствоведы отмечали, что Яблонская изобразила на своей картине «новых людей», которые могут существовать только в социалистическом государстве. Это настоящие хозяева своей жизни, которые по-новому воспринимают свою жизнь и деятельность. Произведение было задумано и создано художницей как «обобщённый образ радостной, свободной творческой работы». По мнению французского искусствоведа Марка Дюпети, эта картина стала для своего времени программным произведением и образцом украинской реалистической живописи XX столетия.
Свойства
Физические свойства
Химические свойства
В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5: Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III): (AlF3 — как кислота) (AlF3 — как основание)При условии, если фтороводород в газообразном состоянии: При условии, если фтороводород в виде водного раствора: Kd= 7,2⋅10−4 Kd= 5,1Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все соли плавиковой кислоты ядовиты.
Изображение дня

Рассвет в деревне Бёрнсте в окрестностях Дюльмена, Северный Рейн-Вестфалия
Из новых материалов
Получение
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Фтористый водород

Фтóроводоро́д (гидрофтори́д, фтóристый водорóд, фтори́д водорóда, HF) — бесцветный газ (при стандартных условиях) с резким неприятным запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF. Токсичен, ПДКр.з. = 0,5 мг/м³, II класс опасности (высокоопасные вещества) в соответствии с ГОСТ 12.1.007-76.
Содержание
- 1 Строение молекулы
- 2 Свойства
- 2.1 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Токсикология
- 6 Применение
- 7 Интересные факты
- 8 Примечания
- 9 Литература
Строение молекулы [ | ]
Молекула фтороводорода сильно полярна, μ = 0,19 Д. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 41,5 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.

В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Свойства [ | ]
Физические свойства [ | ]
- Критическая температура фтористого водорода 188 °C, критическое давление 64 атм.
- Теплота испарения жидкого HF в точке кипения составляет лишь 7,5 кДж/моль (примерно в 6 раз меньше, чем у воды при 20 °C). Это обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (димерная форма, характерная для жидкости, сохраняется и в парах — в отличие от фазового перехода воды).
- Диэлектрическая проницаемость жидкого фтористого водорода (84 при 0 °C) очень близка к значению д.п. для воды.
Химические свойства [ | ]
- Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
M g O + 2 H F → M g F 2 + H 2 O 
- Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
H C l + 2 H F ⇄ H 2 C l + + H F 2 −  В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5: B F 3 + 2 H F → H 2 F + + [ B F 4 ] −
В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5: B F 3 + 2 H F → H 2 F + + [ B F 4 ] −  Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III): 3 N a F + A l F 3 → 3 N a + + [ A l F 6 ] 3 −
Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III): 3 N a F + A l F 3 → 3 N a + + [ A l F 6 ] 3 −  (AlF3 — как кислота) A l F 3 + 3 B F 3 → A l 3 + + 3 [ B F 4 ] −
(AlF3 — как кислота) A l F 3 + 3 B F 3 → A l 3 + + 3 [ B F 4 ] −  (AlF3 — как основание)
(AlF3 — как основание)
- Фтороводород в газообразном состоянии и в виде водного раствора реагирует с диоксидом кремния:
При условии, если фтороводород в газообразном состоянии: 4 H F + S i O 2 → S i F 4 + 2 H 2 O  При условии, если фтороводород в виде водного раствора: 6 H F + S i O 2 → H 2 [ S i F 6 ] + 2 H 2 O
При условии, если фтороводород в виде водного раствора: 6 H F + S i O 2 → H 2 [ S i F 6 ] + 2 H 2 O 
- Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
2 H F + H 2 O ⇄ H F 2 − + H 3 O +  Kd= 7,2⋅10 −4 H F + F − ⇄ H F 2 −
Kd= 7,2⋅10 −4 H F + F − ⇄ H F 2 −  Kd= 5,1 Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все растворимые соли плавиковой кислоты очень ядовиты (в больших дозах).
Kd= 5,1 Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все растворимые соли плавиковой кислоты очень ядовиты (в больших дозах).
Получение [ | ]
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
H 2 + F 2 → 2 H F 
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
C a F 2 + H 2 S O 4 → C a S O 4 + 2 H F 
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Токсикология [ | ]
Фтористый водород (гидрофторид) обладает резким запахом, очень ядовит, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей. Фтороводород обладает слабыми наркотическими свойствами.
Как и некоторые другие производные фтора, HF высокоопасен в обращении.
Подробнее о токсикологии фтороводорода см в ст. Плавиковая кислота.
Применение [ | ]
Применяют для получения криолита, фтористых производных урана, фреонов, фторорганических веществ, матового травления силикатного стекла (плавиковую кислоту — для прозрачного травления). Необычная растворимость биологических молекул в жидком фтороводороде без разложения (напр., белков) используется в биохимии. Добавление в жидкий фтороводород акцепторов фтора позволяет создавать сверхкислые среды.
Фтористый водород.
Физические свойства фтористого водорода.
Фтористый водород (гидрофторид) представляет собой бесцветную, подвижную и легколетучую жидкость (т. кип. +19,5 °С), смешивающуюся с водой в любых соотношениях. Он обладает резким запахом, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей.
Критическая температура фтористого водорода равна 188 °С, критическое давление 64 атм. Теплота испарения жидкого НF в точке кипения составляет лишь 7,5 кДж/моль. Столь низкое значение (примерно в 6 раз меньшее, чем у воды при 20 °С) обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (в отличие от воды). Подобно плотности (0,99 г/см 3 ), диэлектрическая проницаемость жидкого фтористого водорода (84 при 0 °С) очень близка к значению ее для воды.
Химические свойства гидрофторида.
В отличие от свободного фтора фтористый водород (НF) и многие его производные используются уже с давних пор.
Совершенно безводный или близкий к этому состоянию фтористый водород почти мгновенно обугливает фильтровальную бумагу. Этой пробой иногда пользуются для контроля степени его обезвоживания. Более точно такой контроль осуществляется определением электропроводности у безводного фтористого водорода она ничтожно мала, но даже следы воды (как и многих других примесей) резко ее повышают.
Многие неорганические соединения хорошо растворимы в жидком НF, причем растворы являются, как правило, проводниками и электрического тока.
Как показывает определение плотности пара, вблизи точки кипения молекулы газообразного фтористого водорода имеют средний состав, приблизительно выражаемый формулой (НF)4. При дальнейшем нагревании ассоциированные агрегаты постепенно распадаются и кажущийся (средний) молекулярный вес уменьшается, причем лишь около 90 °С достигает значения 20, соответствующего простой молекуле НF .
Существующая у жидкого фтористого водорода ничтожная электропроводность обусловлена его незначительной ионизацией по схеме:
связанной с характерной для НF склонностью к образованию иона гидродифторида — НF2 — [имеющего линейную структуру с атомом водорода в центре и d(FF) = 227 пм]. Напротив, образование иона фторония (Н2F + ) для НF нехарактерно, что и ограничивает самоионизацию (К = 2·10 -11 ). Тенденция к образованию иона НF2 — , накладывает свой отпечаток на всю химию фтористого водорода.
Помимо воды, из неорганических соединений в жидком HF хорошо растворимы фториды, нитраты и сульфаты одновалентных металлов (и аммония), хуже — аналогичные соли Mg, Сa, Sr и Вa. По рядам Li-Сs и Мg-Ва, т. е. по мере усиления металлического характера элемента, растворимость повышается. Щелочные и щелочноземельные соли других галоидов растворяются в НF с выделением соответствующего галоидоводорода. Соли тяжелых металлов в жидком HF, как правило, нерастворимы. Наиболее интересным исключением является ТlF, растворимость которого очень велика (в весовом отношении около 6 : 1 при 12 °С). Практически нерастворимы в жидком НF другие галоидоводороды. Концентрированная серная кислота взаимодействует с ним по схеме:
Жидкий фтористый водород является лучшим из всех известных растворителем белков.
Растворы воды и солей в жидком фтористом водороде хорошо проводят электрический ток, что обусловлено диссоциацией, например, по схемам:
Аналогичное отношение к НF характерно и для многих кислородсодержащих органических молекул. Так, в водной среде глюкоза является типичным неэлектролитом, а в жидком НF наоборот, типичным электролитом за счет взаимодействия по схеме:
Химическая активность НF существенно зависит от отсутствия или наличия воды. Сухой фтористый водород не действует на большинство металлов. Не реагирует он и с оксидами металлов. Однако если реакция с оксидом начнется хотя бы в ничтожной степени, то дальше она некоторое время идет с самоускорением, так как в результате взаимодействия по схеме
количество воды увеличивается.
Случаи взаимодействия сухого фтористого водорода с оксидами металлов и металлоидов, рассмотренные выше, могут служить типичным примером аутокаталитических реакций, т. е. таких процессов, при которых катализатор (в данном случае — вода) не вводится в систему извне, а является одним из продуктов реакции. Cкорость подобных процессов сначала, по мере увеличения в системе количества катализатора, нарастает до некоторого максимума, после чего начинает уменьшаться вследствие понижения концентраций реагирующих веществ.
Подобным же образом действует фтористый водород и на окислы некоторых металлоидов. Практически важно его взаимодействие с двуокисью кремния — SiO2 (песок, кварц), которая входит в состав стекла. Реакция идет по схеме
Поэтому фтористый водород нельзя получать и сохранять в стеклянных сосудах.
На взаимодействии НF и SiO2 основано применение фтористого водорода для травления стекла. При этом вследствие удаления частичек SiO2 его поверхность становится матовой, что и используют для нанесения на стекло различных меток, надписей и т. п.
Перед фигурным травлением стекла его обычно покрывают тонким слоем воска, а затем снимают этот слой на тех местах, которые должны быть протравлены. Под действием паров НF места эти становятся матовыми, тогда как под действием плавиковой кислоты они остаются прозрачными. Матовое травление в жидкости достигается предварительным добавлением к плавиковой кислоте нескольких процентов фтористого аммония.
В водном растворе НF ведет себя как одноосновная кислота средней силы. Продажный раствор этой фтористоводородной (иначе, п л а в и к о в о й) кислоты содержит обычно 40% НF.
Техническая плавиковая кислота обычно содержит ряд примесей — Fе, Рb, Аs, Н2SiF6, SO2) и др. Для грубой очистки ее подвергают перегонке в аппаратуре, изготовленной целиком из платины (или свинца), отбрасывая первые порции дистиллята. Если этой очистки недостаточно, то техническую кислоту переводят в бифторид калия, затем разлагают его нагреванием и растворяют получающийся фтористый водород в дистиллированной воде. Крепкая плавиковая кислота (более 60% НF) может сохраняться и транспортироваться в стальных емкостях. Для хранения плавиковой кислоты и работы с ней в лабораторных условиях наиболее удобны сосуды из некоторых органических пластмасс. Крупным потребителем фтористоводородной кислоты является алюминиевая промышленность.
Растворение фтористого водорода в воде сопровождается довольно значительным выделением тепла (59 кДж/моль). Характерно для него образование содержащей 38,3 % НF и кипящей при 112 °С азеотропной смеси (по другим данным 37,5 % и т. кип. 109 °С). Такая азеотропная смесь получается в конечном счете при перегонке как крепкой, так и разбавленной кислоты.
При низких температурах фтористый водород образует нестойкие соединения с водой состава Н2О·НF, Н2О·2НF и Н2О·4НF. Наиболее устойчиво из них первое (т. пл. -35 °С), которое следует рассматривать как фторид оксония — [Н3O]F.
Помимо обычной электролитической диссоциации по уравнению
HF Ы H + + F — (К = 7·10 -4 ),
для растворов фтористоводородной кислоты характерно равновесие:
Значение константы этого равновесия ([НF2‘]/[F’][НF]=5) показывает, что в не очень разбавленных растворах НF2‘ содержится больше анионов чем простых анионов F’. Например, для приводимых ниже общих нормальностей (С) приближенно имеем:
| С | [НF] | [Н + ‘] | [F — ] | [HF2‘] |
| 0,100 | 0,088 (88 %) | 0,009 (9 %) | 0,006 (6 %) | 0,003 (3 %) |
| 1,000 | 0,890 (89 %) | 0,006 (6 %) | 0,010 (1 %) | 0,050 (5 %) |
Фтористоводородная кислота (ацидофторид) более или менее энергично реагирует с большинством металлов. Однако во многих случаях реакция протекает лишь на поверхности, после чего металл оказывается защищенным от дальнейшего действия кислоты слоем образовавшейся труднорастворимой соли. Так ведет себя, в частности, свинец, что и позволяет пользоваться им для изготовления частей аппаратуры, устойчивой к действию НF.
Соли фтористоводородной кислоты носят название ф т о р и с т ы х или ф т о р и д о в. Большинство их малорастворимо в воде — из производных наиболее обычных металлов хорошо растворяются лишь фториды Nа, К, Ag, A1, Sn и Нg. Все соли плавиковой кислоты ядовиты. Сама она при попадании на кожу вызывает образование болезненных и трудно заживающих ожогов (особенно под ногтями). Поэтому работать с плавиковой кислотой следует в резиновых перчатках.
Весьма характерно для фтористого водорода образование продуктов присоединения к фторидам наиболее активных металлов. Соединения эти, как правило, хорошо кристаллизуются и плавятся без разложения. Примером могут служить производные калия — КF·НF (т. пл. 239 °С), КF·2НF (62 °С), КF·3НF (66 °С) и КF·4НF (72 °С). Строение этих продуктов присоединения отвечает, вероятно, формулам вида К[F(НF)n] с водородными связями между ионом F- и молекулами HF. Разбавленные растворы гидродифторида калия (КНF2) применяются иногда для удаления пятен от ржавчины.
Атом, молекула гидрофторида.
Связь Н-F характеризуется ядерным расстоянием 0,92 А. По отношению к нагреванию фтористый водород очень устойчив: его термическая диссоциация становится заметной лишь около 3500 °С.
Молекула НF весьма полярна ( m = 1,74). С наличием на атомах значительных эффективных зарядов хорошо согласуется резко выраженная склонность фтороводорода к а с с о ц и а ц и и путем образования водородных связей по схеме ···Н-F···Н-F···.
Энергия такой связи составляет около 33,4 кДж/моль, т. е. она прочнее, чем водородная связь между молекулами воды.
Кристаллы твердого фтористого водорода слагаются из зигзагообразных цепей ···Н-F···Н-F···Н-F···, образованных при посредстве водородных связей. Расстояние d(FF) в таких цепях — 249 пм, а угол зигзага — 120°. Теплота плавления твердого НF (т. пл. -83 °С, плотность 1,6 г/см 3 ) составляет 3,8 кДж/моль, что близко к значению для льда. Для жидкого фтористого водорода наиболее вероятно одновременное существование и цепей, и колец из молекул НF.
Внимание! Фтористый водород ядовит!
Хроническое отравление фторидами может быть вызвано как повышенным их содержанием в питьевой воде, так и вдыханием их с воздухом в виде пыли. В результате подобного отравления наблюдается разрушение зубной эмали. Существенно увеличивается также хрупкость костей, что создает предпосылки для их переломов. Имеются указания на то, что повышенное содержание фторидов в воде и воздухе способствует заболеванию зобом. Помимо фторной промышленности, с возможностью хронического отравления фтористыми соединениями приходится особенно считаться при выработке алюминия и суперфосфата. Предельно допустимой концентрацией связанного фтора в воздухе производственных помещений считается 5·10 -4 мг/л.
Получение фтористого водорода.
Непосредственное соединение фтора с водородом сопровождается значительным выделением тепла:
Реакция протекает обычно со взрывом, который происходит даже при сильном охлаждении газов и в темноте. Практического значения для получения НF этот прямой синтез не имеет, но, в принципе, он может быть использован для создания реактивной тяги.
Промышленное получение фтористого водорода основано на взаимодействии СаF2 с концентрированной Н2SO4 по реакции:
Процесс проводят в стальных печах при 120-300 °С. Части установки, служащие для поглощения НF, делаются из свинца.
В качестве реактивного топлива смесь фтора с водородом способна давать удельный импульс 410 сек. Бесцветное пламя, возникающее при взаимодействии этих газов, может иметь температуру до 4500 °С. В лабораторных условиях для получения чистого фтористого водорода применяются обычно небольшие установки изготовленные целиком из платины (или меди). Исходным веществом служит тщательно высушенный бифторид калия (КF·НF), при нагревании разлагающийcя c отщеплением НF. Полученный продукт часто содержит примесь механически увлеченного бифторида. Для очистки его подвергают перегонке при 35-40 °С.