Хлорциан отравляющее вещество
СИНИЛЬНАЯ КИСЛОТА И ХЛОРЦИАН
ОТРАВЛЯЮЩИЕ ВЕЩЕСТВА ОБЩЕЯДОВИТОГО ДЕЙСТВИЯ
К ОВ общеядовитого действия относятся синильная кислота и хлорциан. Несмотря на то, что применение синильной кислоты французской армией в первую мировую войну было не эффективным, она привлекает внимание военных химиков капиталистических армий главным образом потому, что может вызывать очень быстрое развитие клиники поражения и гибель в течение нескольких минут на поле боя.
В данной главе рассматриваются также вопросы токсикологии окиси углерода, хотя она не состоит на вооружении в качестве ОВ, но отравления ею возможны как в боевых, так и в мирных условиях. В заключение дается краткое описание токсикологии диоксина, который применялся армией США в Южном Вьетнаме в составе «оранжевого агента».
СИНИЛЬНАЯ КИСЛОТА И ХЛОРЦИАН
Синильная кислота и хлорциан состоят на вооружении ряда капиталистических армий в качестве нетабельных (запасных) ОВ. Кроме того, синильная кислота и ее соли (цианиды) находят широкое применение в промышленности (для извлечения золота и серебра из руд, золочения и серебрения предметов, крашения и протравливания тканей и т. д.), в сельском хозяйстве и на транспорте для дезинсекции и дератизации и т. п. Поэтому они производятся в большом количестве и могут быть отравления при производстве, транспортировке и использовании синильной кислоты и цианидов. Отравления могут быть при употреблении ядер (семян) косточек горького миндаля, абрикосов, персиков, вишен, слив, груш и других, содержащих глюкозид амигдалин, в состав которого входит цианистая группа.
3.1.1. ФИЗИКО-ХИМИЧЕСКИЕ И ТОКСИЧЕСКИЕ СВОЙСТВА Синильная кислота (HCN)—бесцветная летучая жидкость я запахом горького миндаля. Температура кипения 26°С, поэтому она быстро испаряется и относится к типичным нестойким ОВ
(стойкость на местности в летнее время 20—30 мин). Температура замерзания — 14°С. Плотность паров 0,93, то есть пары ее легче воздуха. Синильная кислота хорошо растворяется в воде и органических растворителях, фосгене, иприте и других ОВ.
Синильная кислота, как и другие кислоты, со щелочами образует соли, цианиды; HCN + KOH->KCN + H2O; HCN + NaOH-> -^NaCN+H2O и др.
Цианиды — это твердые кристаллические вещества, очень ядовитые (смертельная доза при приеме внутрь около 150 мг). С солями железа, кобальта и других тяжелых металлов синильная кислота образует стойкие комплексные соли, Ks[Fe(CN)e]> K4[Fe(CN)6]; K4[Au(CN)6], K4[Co(CN)6] и другие, которые в обычных условиях неядовиты.
Синильная кислота легко присоединяется к альдегидам, например, к формальдегиду, с образованием сравнительно малотоксичных оксинитрилов (циангидринов), а также к глюкозе (ее альдегидной группе):

Синильная кислота и цианиды могут вступать в реакцию с активными соединениями серы с образованием малотоксичных роданидов:
Синильная  . ни с образо-
. ни с образо-
ванием галоидцианов: C1CN, BrCN, FCN, JCN, из которых хлор-циан состоит на вооружении как ОВ.
Хлорциан (C1CN)—бесцветная жидкость с резким раздражающим запахом. Температура кипения 13,4°С; обладает высокой летучестью и поэтому еще меньшей стойкостью. _Пары enf в два раза тяжелее воздуха. Остальные свойства аналогичны синильной кислоте.
Токсичность. Синильная кислота и хлорциан вызывают главным образом ^днгялЯ!»* 0 «»» 13 ппряжрния Опасными для человека являются пары синильной кислоты в концентрации 0,1— 0,12 мг/л, которые при экспозиции 15—20 мин вызывают тяжелое поражение. Смертельными считаются концентрации 0,2— 0,3 мг/л при экспозиции 5—10 мин; 0,4—0,8 мг/л при экспозиции 2—5 мин вызывают быструю смерть.
Пары хлорциана несколько менее токсичны: 0,4—0,8 мг/л вызывают смертельное поражение при экспозиции 5 мин.
3.1.2. МЕХАНИЗМ ДЕЙСТВИЯ И ПАТОГЕНЕЗ ПОРАЖЕНИЯ
Было отмечено, что при отравлении цианидами венозная кровь приобретает ярко-злую окраску и содержит много кислорода, как и артериальная. Исследованиями Гоппе — Зейлера, Гепнера и Варбурга было установлено, что это происходит вследствие присоединения циангруппы к тканевым окислительным ферментам, в частности к цитохромоксидазе (цитохрому а3). Происходит иняктив^пия пнтохромоксидазы, поэтому она теряет ‘способность переносить кислород из крови в ткани и_р_азвивается__1каыевая туянрвпр дыхание угнетается почти на 90 — 95%, хотя
содержание кислорода в крови повышено.
Как известно, тканевое дыхание, то есть ферментативное окисление углеводов и других веществ, происходит путем отщепления водорода от окисляющихся субстратов с помощью ферментов дегидрогеназ, активными группами в которых являются НАД (никотинамидаденидиннуклеотид) и НАДФ (никотинамидаденин-нуклеотидфосфат). Отщепившийся водород и электроны проходят через флазиновые ферменты (флавопротеиды), в которых активными группами являются ФМН (флавинмононуклеотид) и ФАД ‘(флавинадениндину’клеотид), после этого передаются на кофермент Q, KoQ (убихинон). Затем электроны передаются на цитохромную систему — цитохромы bi, сь с, а и а3. Цитохром аз называется также цитохромоксидазой. Цитохромоксидаза представляет собой сложный белковый фермент, по своему строению близкий к гемоглобину, состоит из белковой части и геминовой группы, в состав которой входит железо. В начальной восстановленной форме железо двухвалентно. Цитохромоксидаза способна воспринимать и активировать кислород из крови: она переносит один электрон железа на кислород, при этом железо становится трехвалентным, а кислород активируется и легко соединяется с водородом, переданным флавиновыми ферментами, с образованием воды и выделением энергии, которая кумулируется в АТФ. Циангруппа_ обладает свойством легко соединяться с трехвалентным железом окисленной формы цитохромоксидазы (цитохро-ма аз) вместо электрона, перенеСенниго» на Кислород,’ что и приводит к угнетению тканевого дыхания (рис. 21), ткани теряют способность получать кислород из крови.
Характерными признаками тканевой (гистотоксичной) гипоксии являются артериализация венозной крови, когда венозная кровь насыщена оксигемоглобином наравне с артериальной, и розовая или ярко-красная окраска кожи, слизистых оболочек и внутренних органов.
Синильная кислота в организме может обезвреживаться путем реакции с глюкозой и серусодержащими соединениями. Поэтому в малых дозах она не вызывает отравления, а при поражениях легкой степени симптомы отравления довольно быстро исчезают.
При отравлении цианистыми соединениями на первый план

Рис. 21. Схема тканевого дыхания и механизма действия цианидов.
выступают клинические симптомы поражения нервной системы. Даже в малых дозах, когда не обнаруживается никаких видимых симптомов, они вызывают нарушение условных рефлексов (Ю. П. Фролов, 1944). В токсических доз*’ах цианиды вызывают возбуждение центральной нервной системы, судороги, затем угнетение и смерть от паралича центров продолговатого мозга. По-видимому, это объясняется тем, что нервная система наиболее чувствительна к кислородному голоданию. Кроме этого, отмечено повышенное накопление синильной кислоты в ткани мозга, богатой липидами.
3.1.3. КЛИНИКА ПОРАЖЕНИЯ
В зависимости от концентрации паров синильной кислоты,
экспозиции и особенностей организма различают поражения легкой, средней и тяжелой степени, а также молниеносную форму. Поражение легкой степени (при низких концентрациях и коротких экспозициях) характеризуется в основном субъективными ощущениями: запах горького 1ЩНП ялд , мр
таллический привкуг- пг» рту иунгтип гпррци ссаднение в носу и )a грудиной, стеснение в гпу т д^я-бпгтк После надевания про-
тивогаза или выхода из отравленной атмосферы синильная кислота быстро обезвреживается в организме, и через несколько минут все эти симптомы исчезают.
Поражение средней степени характеризуется выраженными явлениями тканевого кислородного голодания. При этом наряду с вышеописанными симптомами появляются голов ная боль. шум в ушах, биение височных артерий, тошнота, иногда рвота, беспокойство, онемение слизистых полости рта. Иояв-згяютгя ^лышкя, поли в области сердца, затруднение речи, небольшое слюнотечение ^радикардия, мышечная слабость. Слизи-стые оболочки и лицо принимают розовую окраску. Часто наблюдаются возбуждение и страх-смерти ..вследствие резкой одышки.
С прекращением поступления яда в организм симптомы отравления относительно быстро (через 30—60 мин) ослабевают, но в течение 1—3 сут остаются ощущение общей разбитости, сла-1 бости, головные боли, легкое расстройство походки, боли в области сердца и др.
При поражении тяжелой степени происходит прежде всего быстрое развитие всех описанных симптомов, а в последующем — наступление судорог и часто смертельный исход.
Клинику тяжелого поражения принято делить на четыре стадии. Начальная _гтялия появляется сразу, без скрытого периода. Пораженный ощущает запах горького миндаля, металлический вкус во рту, стеснение в груди, шум в ушах, биение дисочных артерий, головокружение, слабость, тошноту, беспокойство, сердцебиение:—————•——‘»
» Стадия одышки характеризуется резким кислородным голоданием. Появляется^ мучительная одышка- но кожные покровы приобретают розовую окраску. Дыхание становится частым и глубоким. Часто наблюдаются боли в области герлия стенокардичес-
_jcoro характера. Пулы яямр.ллрнный. напряженный. Пораженные беспокойны, возбуждены, мучимы страхом смерти. Отмечаются резкая слабость, шаткая походка, иногда ригидность мышц и подергивания мышц лица. Зрачки могут быть расширены, сознание затемнено.
Затем состояние пораженного быстро ухудшается, он теряет сознание, падает и начинается судорожная стадия с сильными тонико-клоническими судорогами всего тела. Во время судорог Полнив иикрЬвь! И слизистые резко розовой окраски, зрачки расширены, глазные яблоки выпячиваются из глазницы (мидриаз и экзофтальм), корнеальный рефлекс отсутствует. Изо рта выделяется небольшое количество слюны. Пульс замедленный (вагус-ный), артериальное давление в пределах нормы или повышено. Дыхание редкое, аритмичное. Нередко отмечаются непроизвольные мочеиспускание и дефекация. Длительность судорожной стадии может варьировать от нескольких минут до нескольких часов.
Если в судорожной стадии не будет оказана медицинская помощь, быстро может наступить паралитическая гт^пия При этом судороги прекращаются, все мышцы расслабляются, наступает адинамия, рефлексы отсутствуют. Дыхание становится редким, поверхностным, прерывистым. Пульс учащается, артериальное давление .резко снижается. Затем наступают паралич дыхательного центра и остановка дыхания. Сердце еще в течение 3— 82
5 мин продолжает сокращаться, и пораженного можно еще спасти.
Молниеносная форма по/ражения является самой неблагоприятной в отношении прогноза и оказания медицинской помощи. При этом пораженный почти сразу теряет сознание, падает, судорожная стадия длится всего минуты, пораженный как бы застывает от остановки дыхания с расширенными, выпученными глазами, но сердечная деятельность еще продолжается несколько минут.
При тяжелых поражениях со стороны крови отмечаются небольшое увеличение содержания гемоглобина и эритроцитов, лейкоцитоз со сдвигом формулы влево, лимфопения и анэозинофи-лия, гипергликемия, повышенное содержание кислорода в венозной крови. Как правило, наблюдаются резкие нарушения электрокардиограммы по типу коронарной и мышечной недостаточности «(нарушение зубца Т и отрезка ST).
У пораженных, перенесших тяжелое отравление синильной кислотой, в течение 1 — 2 нед отмечаются чувство тяжести в груди, затруднение речи, головные боли, дискоординация движений, тошнота, лабильность пульса, нарушения электрокардиограммы, повышенная утомляемость, слабость. Могут быль тяжелые осложнения: аспирационная пневмония, парезы, параличи различных мышечных групп и нарушения психики.
Особенности поражения хлорцианом.Хлорциан, как и синильная кислота, является ядом тканевых оксидаз (цитохромокси-дазы), однако в клинике поражения имеются особенности. Хлор-
Дата добавления: 2015-08-14 ; просмотров: 2984 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Хлорциан
Чрезвычайно токсичен, СДЯВ

Хлорциан — хлорангидрид циановой кислоты ClCN, бесцветный газ (при нормальных условиях) с резким запахом, высокотоксичен. Хлорциан — легко сжижающийся газ (давление паров при 20 °C = 1002 мм рт. ст.) с температурой плавления −6.9 °C, в твердой фазе образует кристаллы ромбической сингонии.
Содержание
- 1 Реакционная способность
- 2 Токсичность
- 3 Применение
- 3.1 В химическом производстве
- 3.2 Как отравляющее веществo
- 4 Примечания
- 5 Литература
- 6 Ссылки
Реакционная способность
Хлорциан является типичным псевдогалогеном и обладает высокой реакционной способностью по отношению к нуклеофилам, для него типичны как реакции замещения хлора, так и присоединения к тройной связи. Так, он взаимодействует со щелочами с образованием цианатов щелочных металлов:
C l C N + 2 N a O H → N a O C N + N a C l + H 2 O 
Хлорциан медленно гидролизуется водой в нейтральных и кислых растворах с образованием изоциановой кислоты, которая, в свою очередь, гидролизуется с образованием аммиака и диоксида углерода:
C l C N + H 2 O → H N C O + H C l  H N C O + H 2 O → N H 3 + C O 2
H N C O + H 2 O → N H 3 + C O 2 
C аммиаком хлорциан образует цианамид:
C l C N + N H 3 → H 2 N — C N + H C l 
Реакции с азотными и кислородными нуклеофилами, начинаясь с замещения хлора, могут сопровождаться последующим присоединением к тройной углерод-азотной связи: так, первичные и вторичные амины образуют с хлорцианом сначала N-замещенные цианамиды, а затем — гуанидины:
C l C N + R 2 N H → R 2 N — C N + H C l  2 R 2 N — C N + B → ( R 2 N ) 2 C = N H
2 R 2 N — C N + B → ( R 2 N ) 2 C = N H 
В отличие от аминов, при взаимодействие хлорциана со спиртами продукты замещения алкоксилом хлора — эфиры циановой кислоты — не образуются, реакция ведет к образованию нестойких имидоэфиров угольной кислоты:
C l C N + 2 R O H → ( R O ) 2 C = N H + H C l 
Хлорциан реагирует и с углеродными нуклеофилами, при этом идут реакции замещения хлора. Так, хлорциан при взаимодействии с реактивами Гриньяра образует нитрилы:
R M g C l + C l C N → R C N + M g C l 2 
Ароматические углеводороды цианируются хлорцианом в условиях реакции Фриделя-Крафтса:
A r H + C l C N → A r C N + H C l 
В частности, бензол в этих условиях образует бензонитрил, однако эта реакция имеет ограниченное синтетическое применение.
Токсичность
Чрезвычайно ядовит. По действию хлорциан аналогичен синильной кислоте, поскольку при гидролизе в организме образует цианид-ионы, но в отличие от неё оказывает и раздражающее действие, обусловленное воздействием хлорциана на нуклеофильные функциональные группы рецепторов слизистых оболочек. Смертельная концентрация хлорциана в воздухе: ЛКτ50 = 11 мг·мин/л.
Хлорциан не обладает кумулятивными свойствами, его воздействие проявляется немедленно. При концентрации 0,002 мг/л начинает ощущаться раздражающее действие, а при 0,06 мг/л развивается обильное слезотечение и спазм век. Концентрация 0,4 мг/л может вызвать смертельный исход (достаточно 10-минутного воздействия, при этом смерть наступает в течение 1-15 минут).
Применение
В химическом производстве
Хлорциан является исходным веществом в синтезе цианурхлорида (2,4,6-трихлор-1,3,5-триазина), применяющегося в синтезе гербицидов триазинового ряда и триазиновых активных красителей, синтез проводится каталитической тримеризацией хлорциана:
3 C l C N → C 3 N 3 C l 3 
Как отравляющее веществo
Хлорциан также производился в качестве боевого отравляющего вещества общеядовитого действия, впервые был применен войсками Антанты в июле 1916 года в ходе Первой мировой войны.
Хлорциан, обладающий схожим с синильной кислотой характером токсического действия и уровнем летальной дозы, очень плохо сорбируется угольной шихтой противогаза. При подходящих метеоусловиях можно создавать такие концентрации хлорциана, при которых наступает пробой противогаза, и живая сила противника будет поражена, даже если успеет воспользоваться стандартными средствами защиты от ОВ.
Хлорциан отравляющее вещество
В нашей онлайн базе уже более 10821 рефератов!
Вы можете воспользоваться поиском готовых работ или же получить помощь по подготовке нового реферата практически по любому предмету. Также вы можете добавить свой реферат в базу.
Хлорциан. Хлорциан, как боевое отравляющее вещество
Министерство Здравоохранения Республики Беларусь
Белорусский Государственный Медицинский Университет
Реферат на тему:
Хлорциан. Хлорциан, как боевое отравляющее вещество.
Подготовил студент педиатрического факультета
Хлорциан — хлорангидрид циановой кислоты ClCN, бесцветный газ с резким запахом, высокотоксичен. Хлорциан — легко сжижающийся газ (давление паров при 20 С = 1002 мм.рт.ст) с температурой кипения -6.9 °C, в твердой фазе образует кристаллы ромбической сингонии.


Химическая формула ClCN
Молярная масса 61,46 г/моль
Состояние (ст. усл.) бесцветный газ
Плотность при -30 °C — 1.550 г/см³
Температура плавления -6,9 °C
Температура кипения 12,6 °C
Энтальпия образования (ст. усл.) 134.2 кДж/
Начальная раздражающая концентрация 0,002 мг/л, непереносимая — 0,06 мг/л. Пребывание в течение 10 мин в атмосфере хлорциана с концентрацией 0,4 мг/л может вызвать смертельный исход.
Очерк из истории:
Хлорциан также производился в качестве боевого отравляющего вещество общеядовитого действия, впервые был применен войсками Антанты в июле 1916 года в ходе Первой мировой войны. Страна, первая применившая это вещество – Франция. Соединение являлось смесью хлорциана с треххлористым мышьяком
1. Реакционная способность
3.1 В химическом производстве
3.2 Как отравляющее вещество
4. Исследование на людях
5. Признаки и симптомы отравления
6. Воздействие на окружающую среду / экспозиция:
7. Список использованной литературы
1. Реакционная способность
Хлорциан является типичным псевдогалогеном и обладает высокой реакционной способностью по отношению к нуклеофилам, для него типичны как реакции замещения хлора, так и присоединения к тройной связи. Так, он взаимодействует с щелочами с образованием цианатов щелочных металлов:
ClCN + 2 NaOH NaOCN + NaCl + H2O
Хлорциан медленно гидролизуется водой в нейтральных и кислых растворах с образованием изоциановой кислоты, которая, в свою очередь, гидролизуется с образованием до аммиака и диоксида углерода:
ClCN + H2O HNCO + HCl
HNCO + H2O NH3 + CO2
C аммиаком хлорциан образует цианамид:
ClCN + NH3 H2N-CN + HCl
Реакции с азотными и кислородными нуклеофилами, начинаясь с замещения хлора, могут сопровождаться последующим присоединением к тройной углерод-азотной связи: так, первичные и вторичные амины образуют с хлорцианом сначала N-замещенные цианамиды, а затем — гуанидины:
ClCN + R2NH R2N-CN + HCl
R2N-CN + R2N-CN (R2N)2C=NH
В отличие от аминов, при взаимодействие хлорциана со спиртами продукты замещения алкоксилом хлора — эфиры циановой кислоты — не образуются, реакция ведет к образованию нестойких имидоэфиров угольной кислоты:
ClCN + 2 ROH (RO)2C=NH + HCl
Хлорциан реагирует и с углеродными нуклеофилами, при этом идут реакции замещения хлора. Так, хлорциан при взаимодействии с реактивами Гриньяра образует нитрилы:
RMgCl + ClCN RCN + MgCl2
Ароматические углеводороды цианируются хлорцианом в условиях реакции Фриделя-Крафтса:
ArH + ClCN Ar-CN + HCl ,
В частности, бензол в этих условиях образует бензонитрил, однако эта реакция имеет ограниченное синтетическое применение.
2. Токсичность
По действию хлорциан аналогичен синильной кислоте, поскольку при гидролизе в организме образует цианид-ионы , но в отличие от нее оказывает и раздражающее действие, обусловленное воздействием хлорциана на нуклеофильные функциональные группы рецепторов слизистых оболочек. Смертельная хлорциана концентрация в воздухе: ЛКτ50 = 11 мг·мин/л.
Хлорциан не обладает кумулятивными свойствами, его воздействие проявляется немедленно. При концентрации 0,002 мг/л начинает ощущаться раздражающее действие, а при 0,06 мг/л развивается обильное слезотечение и спазм век. Концентрация 0,4 мг/л может вызвать смертельный исход (достаточно 10-минутного воздействия, при этом смерть наступает в течение 1-15 минут).
3. Применение
3.1.В химическом производстве
Хлорциан является исходным веществом в синтезе цианурхлорида (2,4,6-трихлор-1,3,5-триазина), применяющегося в синтезе гербицидов триазинового ряда и триазиновых активны красителей, синтез проводится каталитической тримеризацией хлорциана.
4. Исследования на людях
Информация предоставлена Мичиганским Департаментом здравоохранения.
Исследования показали, что концентрация примерно 0,7 промилле (1,78 мг/куб м) хлорциана является невыносимой для проведения дальнейшего опыта над людьми. Лица, участвующие в исследовании столкнулись с серьёзными раздражениями слизистых оболочек глаз и носа, после чего, опыты пришлось завершить. Данный процесс проводился в присутствие цианистого раствора с жидким гипохлоритом натрия
5. Признаки и симптомы отравления
Хлорциан, обладающий схожим с синильной кислотой характером токсического действия и уровнем летальной дозы, очень плохо сорбируется угольной шихтой противогаза. При подходящих метеоусловиях можно создавать такие концентрации хлорциана, при которых наступает пробой противогаза, и живая сила противника будет поражена, даже если успеет воспользоваться стандартными средствами защиты от ОВ
С другой стороны, хлорциан обладает свойствами, присущими свойствам при отравлении хлором, о чём свидетельствует атом хлора в молекуле хлорциана. Поэтому, симптомы будут комбинированы, как симптомы при отравлением хлора, так и отравление синильной кислотой.
Анионы цианидов образуют комплексы с ионами двухвалентного железа цитохромоксидазной системы, вмешиваясь в перенос электронов в системе цитохром а-а3, что приводит к блокаде переноса кислорода в ткани и вызывает цитотоксическую тканевую гипоксию.
А ионы хлоры, хорошо растворяясь в воде и тканевых жидкостях, прежде всего поражают
слизистые оболочки верхних дыхательных путей, трахеи, бронхов. При воздействии
высоких концентраций и длительной экспозиции поражение захватывает и глубокие
отделы дыхательных путей. Интенсивное раздражение рецепторного поля дыхательных
путей вызывает рефлекторную реакцию со стороны гладкой мускулатуры трахеи,
бронхов, а также дыхательного и сосудодвигательного центров
Хлорциан вызывает интенсивное раздражение глаз (жгучая боль в глазах с тяжелым блефароспазмом, отёк век, конъюнктивит), раздражение слизистой носа и дыхательных путей. В результате отравления происходит усиленное слезотечение, ринорея, и увеличение производства жидкости железами, а так же в легких.
При ингаляционном поступлении наблюдаются такие симптомы, как:
Ринорея, боли в горле. Сонливость. Путаница. Тошнота. Рвота. Кашель с пенистой мокротой. Потеря сознания. Заметное раздражение дыхательных путей с геморрогическим экссудатом из бронхов и трахеи. Симптомы отека легких (накопление жидкости в легких), часто не проявляются через несколько часов и обостряются при физической нагрузке. Отдых и медицинское наблюдение имеет огромное значение при данных проявлениях.
Кожа: хлорциан легко всасывается через неповрежденную кожу, вызывая системные эффекты без раздражающего воздействия на кожу. Примером является цианоз.
Воздействие на нервную систему: головная боль, чувство тревоги и страха, возбуждение, чувство слабости, судороги, потеря сознания, конвульсии, смерть. Время наступления многих эффектов напрямую зависит от концентрации и времени поглощения.
Пищеварительная система: потеря аппетита, потеря веса, тошнота, как с рвотой, так и без, непроизвольное мочеиспускания (жжение мочи) и дефекация.
Хлорциан
| Хлорциан | |
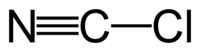 |
|
 |
|
| Общие | |
|---|---|
| Сокращения | CK |
| Химическая формула | ClCN |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Молярная масса | 61,46 г/моль |
| Плотность | при -30 °C — 1.550 г/см³ |
| Термические свойства | |
| Температура плавления | -6,9 °C |
| Температура кипения | 12,6 °C |
| Энтальпия образования (ст. усл.) | 134.2 кДж/моль |
| Классификация | |
| Рег. номер CAS | 506-77-4 |
| SMILES | C(#N)Cl |
Хлорциан — хлорангидрид циановой кислоты ClCN, бесцветный газ (при нормальных условиях) с резким запахом, высокотоксичен. Хлорциан — легко сжижающийся газ (давление паров при 20 С = 1002 мм.рт.ст) с температурой кипения −6.9 °C, в твердой фазе образует кристаллы ромбической сингонии.
Содержание
Реакционная способность
Хлорциан является типичным псевдогалогеном и обладает высокой реакционной способностью по отношению к нуклеофилам, для него типичны как реакции замещения хлора, так и присоединения к тройной связи. Так, он взаимодействует с щелочами с образованием цианатов щелочных металлов:
ClCN + 2 NaOH  NaOCN + NaCl + H2O
NaOCN + NaCl + H2O
Хлорциан медленно гидролизуется водой в нейтральных и кислых растворах с образованием изоциановой кислоты, которая, в свою очередь, гидролизуется с образованием до аммиака и диоксида углерода:
ClCN + H2O  HNCO + HCl HNCO + H2O
HNCO + HCl HNCO + H2O  NH3 + CO2
NH3 + CO2
C аммиаком хлорциан образует цианамид:
ClCN + NH3  H2N-CN + HCl
H2N-CN + HCl
Реакции с азотными и кислородными нуклеофилами, начинаясь с замещения хлора, могут сопровождаться последующим присоединением к тройной углерод-азотной связи: так, первичные и вторичные амины образуют с хлорцианом сначала N-замещенные цианамиды, а затем — гуанидины:
ClCN + R2NH  R2N-CN + HCl R2N-CN + R2N-CN
R2N-CN + HCl R2N-CN + R2N-CN  (R2N)2C=NH
(R2N)2C=NH
В отличие от аминов, при взаимодействие хлорциана со спиртами продукты замещения алкоксилом хлора — эфиры циановой кислоты — не образуются, реакция ведет к образованию нестойких имидоэфиров угольной кислоты:
ClCN + 2 ROH  (RO)2C=NH + HCl
(RO)2C=NH + HCl
Хлорциан реагирует и с углеродными нуклеофилами, при этом идут реакции замещения хлора. Так, хлорциан при взаимодействии с реактивами Гриньяра образует нитрилы:
RMgCl + ClCN  RCN + MgCl2
RCN + MgCl2
Ароматические углеводороды цианируются хлорцианом в условиях реакции Фриделя-Крафтса [1] :
ArH + ClCN  Ar-CN + HCl, в частности, бензол в этих условиях образует бензонитрил, однако эта реакция имеет ограниченное синтетическое применение.
Ar-CN + HCl, в частности, бензол в этих условиях образует бензонитрил, однако эта реакция имеет ограниченное синтетическое применение.
Токсичность
По действию хлорциан аналогичен синильной кислоте, поскольку при гидролизе в организме образует цианид-ионы, но в отличие от неё оказывает и раздражающее действие, обусловленное воздействием хлорциана на нуклеофильные функциональные группы рецепторов слизистых оболочек. Смертельная концентрация хлорциана в воздухе: ЛКτ50 = 11 мг·мин/л.
Хлорциан не обладает кумулятивными свойствами, его воздействие проявляется немедленно. При концентрации 0,002 мг/л начинает ощущаться раздражающее действие, а при 0,06 мг/л развивается обильное слезотечение и спазм век. Концентрация 0,4 мг/л может вызвать смертельный исход (достаточно 10-минутного воздействия, при этом смерть наступает в течение 1-15 минут).
Применение
В химическом производстве
Хлорциан является исходным веществом в синтезе цианурхлорида (2,4,6-трихлор-1,3,5-триазина), применяющегося в синтезе гербицидов триазинового ряда и триазиновых активных красителей, синтез проводится каталитической тримеризацией хлорциана:
3CICN  C3N3CI3
C3N3CI3
Как отравляющее веществo
Хлорциан также производился в качестве боевого отравляющего вещества общеядовитого действия, впервые был применен войсками Антанты в июле 1916 года в ходе Первой мировой войны. [2]
Хлорциан, обладающий схожим с синильной кислотой характером токсического действия и уровнем летальной дозы, очень плохо сорбируется угольной шихтой противогаза. При подходящих метеоусловиях можно создавать такие концентрации хлорциана, при которых наступает пробой противогаза, и живая сила противника будет поражена, даже если успеет воспользоваться стандартными средствами защиты от ОВ. [3]
Хлорциан
Хлорциан – это бесцветный сжатый сжиженный газ с резким запахом. Негорючее. Нагревание приводит к повышению давления с риском взрыва.
В огне выделяет раздражающие или токсичные пары (или газы). Вещество может всасываться в организм при вдыхании.
Аварийная карточка (АХОВ)
В случае пожара: охлаждать баллоны, обливая их водой, но НЕ допускать прямого контакта вещества с водой. В случае возгорания в окрестностях: разрешены все средства пожаротушения.
Провести эвакуацию из опасной зоны! Проконсультироваться со специалистом! Вентиляция. НИКОГДА не направлять струю воды на жидкость. Удалить облако пара, используя мелкие брызги воды. НЕ сливать в канализацию.
При ликвидации аварий с проливом (выбросом) хлорциана изолировать опасную зону в радиусе не менее 400 м, удалить из нее людей, держаться наветренной стороны, избегать низких мест, соблюдать меры пожарной безопасности, не курить. В опасную зону входить в изолирующих противогазах или дыхательных аппаратах (ИП-4М, ИП-5, ИП-6, КИП-8, АИР-324, АИР-317, ИВА-24М, АП-96, АСВ-2) и средствах защиты кожи (костюм Л-1, ОЗК, КИХ-4, КИХ-5, «КАИС»). На удалении от источника химического заражения более 400 м. средства защиты кожи можно не использовать, а для защиты органов дыхания используют фильтрующие общевойсковые противогазы ПМГ, ПМК с коробкой марки В, БКФ, а также гражданские и детские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш с дополнительными патронами ДПГ-3, ДПГ-1.
Нейтрализуют хлорциан: 10%-ным водным раствором щелочи (например, 100 кг едкого натра и 900 л воды) или железного купороса (например, 100 кг железного купороса и 900 л воды) с нормой расхода 14 тонн раствора на 1 тонну хлорциана. При пожаре тушить распыленной водой, воздушно-механической пеной.
Для распыления воды и растворов применяют поливомоечные и пожарные машины, авторазливочные станции (ПМ-130, АЦ, АРС-14, АРС-15), мотопомпы (МП-800), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
При разливе жидкого хлорциана место разлива засыпают активным углем или углем катализатором, обрабатывают дегазирующим раствором № 2-ащ (2-бщ) или 10%-ным водным раствором щелочи или железного купороса. Для утилизации загрязненного грунта на месте разлива срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают водой в контрольных целях.
В зараженной зоне: надевание противогаза на пострадавшего, под маску противогаза амилнитрил, немедленное удаление из зоны заражения.
После эвакуации из зараженной зоны: вдыхание амилнитрита на ватке (можно повторно); покой, тепло; при наличии раны, ссадины на коже обильное промывание водой, мыльным раствором; эвакуация в лечебное учреждение. Полусидячее положение. ПРИ ОБМОРОЖЕНИИ: промыть большим количеством воды, НЕ удалять одежду.
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
БЕСЦВЕТНЫЙ СЖАТЫЙ СЖИЖЕННЫЙ ГАЗ С РЕЗКИМ ЗАПАХОМ
ФИЗИЧЕСКАЯ ОПАСНОСТЬ:
Газ тяжелее воздуха.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Вещество разлагается при разогреве с образованием токсичных и едких паров (цианистого водорода, соляной кислоты, оксидов азота) Реагирует медленно с водой или водяным паром с образованием хлористого водорода.
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании.
РИСК ПРИ ВДЫХАНИИ:
При утечке содержимого очень быстро достигается опасная концентрация этого газа в воздухе.
ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ:
Слезоточивое действие. Вещество сильно раздражает глаза, кожу и дыхательные пути. Вещество может оказывать действие на клеточное дыхание, приводя к судорогам и потере сознания. Воздействие может вызвать смерть. Показано медицинское наблюдение. См. Примечания. Вдыхание этого вещества может вызвать отек легких (см. Примечания). Эффекты могут быть отсроченными. Быстрое испарение жидкости может вызвать обморожение. Показано медицинское наблюдение.
НАЛИЧИЕ ХЛОРЦИАНА ОПРЕДЕЛЯЮТ:
В воздухе промышленной зоны: газоанализатором промышленных химических выбросов ГПХВ-2 на хлорциан в диапазоне измерений 0,001-1,5 мг/м 3 .
На открытом пространстве: приборами СИП «КОРСАР-Х», УПГК СИ «ЛИМБ» ВПХР с индикаторными трубками ИТ-44, ИТ-45, ИТ-47 с порогом чувствительности 0,005 мг/л (5 мг/м 3 ).
В закрытом помещении: приборами СИП «ВЕГА-М»
Температура кипения: 13.8°C
Температура плавления: -6°C
Растворимость в воде: растворимо
Давление паров, кПа при 21.1°C: 1987
Относительная плотность пара (воздух = 1): 2.16
Предельно допустимая концентрация (ПДК) хлорциана в воздухе рабочей зоны производственных помещений составляет 0,2 мг/м 3 , в атмосферном воздухе населенных пунктов 0,06 мг/м 3 . Опасен при вдыхании, проглатывании, попадании на кожу.
Вызывает раздражение глаз, слизистых верхних дыхательных путей, слабость, тошноту, рвоту, боли в диафрагме, головокружение, нарушение координации движения, потерю сознания, судороги. Возможна остановка дыхания и сердца. Пороговая токсодоза 0,75 мг∙мин/л. Максимально допустимая концентрация при применении общевойсковых фильтрующих противогазов 5000 мг/м 3 .
Величина пределов профессионального воздействия не должна превышаться в течение какого-либо периода рабочего дня. Симптомы отека легких часто проявляются через несколько часов и обостряются при физической нагрузке. Поэтому требуется отдых и медицинское наблюдение. Должен рассматриваться вопрос о немедленном введении соответствующего средства врачом или лицом им уполномоченным. В случае отравления этим веществом необходимо специальное лечение; должны быть в наличии соответствующие средства с инструкциями. НЕ обливать водой прохудившуюся емкость (во избежание коррозии емкости). Перевернуть подтекающую емкость местом утечки кверху во избежание утечки газа в жидкой форме.