К какому классу относится этанол
Этиловый спирт


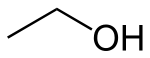
Этиловый спирт (этанол, метилкарбинол, винный спирт) — одноатомный алифатический спирт, бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом. Относится к сильнодействующим наркотикам, вызывающим сначала возбуждение, а затем паралич нервной системы. Имеет формулу CH3CH2OH (упрощённо: С2Н5ОН) [1] .
Этиловый спирт получают сбраживанием пищевого сырья. С 1930−1950-х гг. были разработаны способы получения синтетического спирта гидратацией этилена и гидрированием ацетальдегида. Гидратация этилена стала основным способом производства этилового спирта в 1970-е гг. [2]
Этиловый спирт прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, имеет наркотический эффект: вызывает опьянение, а при многократном употреблении вызывает алкоголизм. Также вредно воздействует на зародыш ребенка.
Содержание
[править] Физические свойства
Этиловый спирт — горючая прозрачная жидкость. Температура плавления = — 114.15 °С, температура кипения = 78,39 °С, плотность 0,7893 г/см³. [2] Молярная масса = 46,069. [3]
[править] Химические свойства
Этанол смешивается во всех соотношениях с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином; образует азеотропные смеси с водой; бензолом; гексаном; толуолом; этилацетатом, а также тройные азеотропные смеси.
Этиловый спирт реагирует с щелочными металлами и с магнием с образованием этилатов и водорода.
Например при реакции с натрием Na образуется этилат натрия:
Аналогично идёт реакция с калием K:
Этанол вступает в реакцию гидрогалогенирования в присутствии хлорида цинка:
При поджигании на воздухе этиловый спирт горит бледно-голубым, синеватым пламенем:
При нагревании в колбе с холодильником этанола с галогеноводородной кислотой, например с HBr (или смесью NаHBr и H2SO4, дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость — бромистый этил C2H5Вг:
При нагревании с серной кислотой (при температуре меньше 120 °C), этиловый спирт превращается в диэтиловый эфир (реакция дегидратации):
Вступает в реакцию дегидратации в присутствии серной кислоты при температуре больше 120 °C с образованием непредельного углеводорода:
Этиловый спирт реагируя с карбоновыми кислотами в присутствии серной кислоты при нагревании приводит к реакции этерификации, например в реакции с уксусной кислотой образуется уксусно-этиловый эфир:
[править] Получение
Этанол получают в основном двумя способами: микробиологическим (спиртовое брожение) и синтетический (гидратация этилена):
Спиртовое брожение представляет собой биохимический процесс превращения сахара в спирт с выделением углекислого газа под воздействием дрожжей вида Saccharomyces cerevisiae и др., по формуле:
Данный метод в основном применяется в пищевой промышленности, не только для производства этилового спирта, но и например при производстве хлебобулочных изделий, при этом дрожжи, выделяемый углекислый газ разрыхляет и поднимает тесто.
В химической промышленности, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
Первый вариант — прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
Второй вариант — гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа:
Реакция осложняется образованием диэтилового эфира.
[править] Практическое значение
Этиловый спирт широко применяется в промышленности.
Этиловый спирт идёт на изготовление спиртных напитков.
Этанол является растворителем в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, взрывчатых веществ и пр.
Этот спирт служит сырьём для производств диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов и пр. Этиловый спирт — компонент антифриза, топливо для реактивных двигателей.
Для технических целей часто используют денатурированный спирт (денатурат) — спирт-сырец, содержащий добавки красителя, окрашивающего этиловый спирт в сине-фиолетовый цвет, и специфических веществ, придающих ему неприятный запах и вкус. Денатурат ядовит.
В медицине этиловый спирт применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов.
[править] Воздействие этилового спирта на человека

Этанол чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении вызывает алкоголизм.
ПДК в атмосфере воздухе 5 мг/м³, в воздухе рабочей зоны 1000 мг/м³.
Помимо признанного ВОЗ и ГОСТ наркотического действия, этиловый спирт обладает тератогенным действием (отрицательно воздействует на зародыш, см. в частности Зависимость числа дебилов от потребления алкоголя), его употребление многократно повышает риски преступности и психиатрических проблем, а также является одной из ведущих причин смертности в России (в частности, вследствие убийств, самоубийств и ведущих причин смертности — атеросклеротического кардиосклероза и нарушения мозгового кровообращения).
ЭТИЛОВЫЙ СПИРТ (ЭТАНОЛ)
I. Общая характеристика.
Этанол иначе называют винным или этиловым спиртом. Это очень важное в практическом отношении соединение. Ниже приведены эмпирическая молекулярная формула (1), структурная формула (2), электронная формула (3):

Л/(С2Н5ОН) = 46 г/моль. Между молекулами этанола (в абсолют— ном, т. е. 100%-м спирте) реализуется водородная связь:

В водных растворах водородная связь реализуется не только между молекулами этанола, но и между молекулами воды:

Спирт, содержащий 4—4,5% воды, называется ректификатом.
Эта смесь — постоянно кипящая (азеотропная), она не может быть разделена при перегонке. Выделить воду из ректификата можно только особыми водоотнимающими средствами, например безводным хлоридом кальция, безводным сульфатом меди(И) или оксидом кальция.
Для доказательства наличия группы ОН в молекуле этанола можно провести количественный опыт. На 1 моль этанола действуют натрием. Обнаружено, что 1 моль натрия реагирует с 1 моль этанола с образованием 11,2л Н2 (н. у.). Следовательно, выделился 1 моль атомов водорода, а из эмпирической формулы видно, что 1 моль этанола содержит 6 моль атомов водорода.
Таким образом, в молекуле этанола один атом водорода занимает особое положение, что и предполагает наличие гидроксогруп- пы.
У этанола есть изомер СН3—О—СН3 (диметиловый эфир), который относится к классу простых предельных эфиров.
II. Физические свойства.
Этанол — бесцветная жидкость со специфическим «алкогольным» запахом. Он смешивается с водой в любых отношениях; его р = 0,79, Т^и = 351,3 К для абсолютного спирта, у ректификата Гкип = 351,15 К. Способность неограниченной растворимости в воде связана с тем, что между молекулами этанола и воды возникают водородные связи. При смешивании воды и этанола наблюдается контракция — уменьшение общего объема; так, смешав 48 мл воды с 52 мл спирта, получают 96,3 мл смеси.
III. Химические свойства.
1. Горит слабосветящимся пламенем, выделяя большое количество энергии: 
- 2. Разлагается: С2Н5ОН-> С, Н20, другие вещества.
- 3. Взаимодействует с щелочными металлами, образуя алкого- ляты, называемые этилатами:

4. Абсолютный спирт может взаимодействовать с сухими щелочами, но эта реакция обратима, так как алкоголяты подвергаются гидролизу: 
Эта реакция не характерна для одноатомных спиртов.
- 5. Вступает в реакции дегидратации. Этанол может подвергаться полной и частичной дегидратации. Реакция протекает при нагревании, катализатор — серная кислота.
- 5.1. Полная (внутримолекулярная) дегидратация состоит в том, что от одной молекулы спирта отщепляется одна молекула воды. Эта реакция протекает в две стадии:

- 6. Подвергается дегидрогенизации (отщепление Н2); реакция идет при повышенной температуре в присутствии никелевого катализатора.
- 7. Окисляется. Этот процесс можно охарактеризовать схемами:

где [О] — условное обозначение окислителя.
8. Вступает в реакцию этерификации с кислотами:


- 9. Взаимодействует с галогеноводородами; реакция обратима, ее можно сместить в сторону образования галогенопроизводных, если вести в присутствии водоотнимающих средств, например при добавлении концентрированной серной кислоты, хлорида кальция и т. д.:
- 10. Способен к совместной дегидратации и дегидрогенизации (см. получение дивинила):

Этанол вступает и в другие химические реакции.
В промышленности этанол получают следующими способами:
1. Брожением углеводов:

Если для брожения используют глюкозу, полученную при гидролизе целлюлозы, то такой спирт называют гидролизным. Получая этанол, предназначенный для пищевых или медицинских целей, в процессах брожения используют крахмал пищевых продуктов, глюкозу и сахарозу, содержащиеся в плодах.
2. Прямой гидратацией этилена; процесс ведется при высокой температуре, катализатор Н3Р04, нанесенная на силикагель (катализатором может быть и серная кислота):

3. Из метанола в смеси с синтез-газом; реакция идет при нагревании в присутствии кобальтового катализатора:

4. В лаборатории этанол можно получать из галогенопроизводных этана или восстановлением этаналя:

Эти реакции интересны в генетическом отношении.
Трудно назвать область промышленности, где бы этанол не находил применения. Как растворитель он используется для обработки различных деталей в машиностроении, приборостроении и т. д. Используют этанол и для экстракции (выделения) различных веществ из природных смесей, в том числе и из растений. Этанол обладает обеззараживающим действием, поэтому широко применяется в медицине.
Способность этанола к сгоранию используется в двигателях внутреннего сгорания, где он может быть достойным конкурентом бензинов, тем более что является экологически более чистым веществом. Этиловый спирт широко применяется как реактив в органическом синтезе, в частности, для получения синтетического каучука, сложных эфиров, альдегидов, уксусной кислоты и других веществ. Применяется этанол и в пищевой промышленности, в том числе для приготовления алкогольных напитков.
Следует помнить, что этиловый спирт оказывает вредное воздействие на организм, поэтому при длительном и неумеренном употреблении алкогольных напитков возникают трудноизлечимые заболевания, в том числе алкоголизм.
- ? Задания для самостоятельной работы
- 1. Поясните, почему этанол относится к предельным одноатомным спиртам; ответ обоснуйте описанием эксперимента.
- 2. Поясните, чем полная дегидратация отличается от частичной дегидратации; напишите соответствующие уравнения реакций.
- 3. Рассчитайте массу (г) воды, содержащейся в 4 л спирта-ректификата. Содержание воды принять за 4%; плотность 0,8. Ответ: 128 г.
- 4. Приведите два обоснованных примера, иллюстрирующих экологическую роль этанола.
- 5. Приведите три обоснованных примера, иллюстрирующих применение этанола.
Этиловый спирт – это… Что такое Этиловый спирт? || К какому классу относится спирт
Получение
Брожение
C6H12O6 → 2C2H5OH 2CO2
В результате брожения получается раствор, содержащий не более 15 % этанола, так как в более концентрированных растворах дрожжи обычно гибнут. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
Химические свойства
Внешний вид: в обычных условиях представляет собой бесцветную летучую жидкость с характерным запахом. Следует избегать популярной ошибки: часто смешивают свойства 95.57 % спирта и абсолютизированного. Их свойства почти одинаковы, но величины начинают различаться начиная с 3 — 4-ой значащей цифры.
(температурный коэффициент показателя преломления 4,0·10 −4 , справедлив в интервале температур 10—30 °C)
Смесь 96 % спирта и 4 % воды (95.57 % этанола 4.43 % воды) является азеотропной — т. е. не разделяется при перегонке.
Взаимодействует со щелочными металлами с образованием этилатов (или в общем случае — алкоголятов) и водорода.
Применение этанола в качестве автомобильного топлива
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей, двигателей внутреннего сгорания в чистом виде. Ограничено в силу своей гигроскопичности (отслаивается) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
- Служит сырьём для получения многих химических веществ, таких, как ацетальдегид , диэтиловый эфир , тетраэтилсвинец , уксусная кислота , хлороформ , этилацетат , этилен и др.;
- Широко применяется как растворитель (в лако красочной промышленности, в производстве товаров бытовой химии и многих других областях);
- Является компонентом антифриза и стеклоомывателей .
- В бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
В медицине этиловый спирт в первую очередь используется как
- как обеззараживающее и подсушивающее средство, наружно;
- дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств , для приготовления настоек , экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции легких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания) [2] ;
- антидот при отравлении этиленгликолем и метиловым спиртом ;
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая даже такие как зубные пасты, шампуни, средства для душа, и т. д.
Наряду с водой, является необходимым компонентом спиртных напитков (водка, виски, джин и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1−3 % этанола (в крепком до 4,5 %), в квасе — от 0,6 до 2,2 %.
Растворитель для пищевых ароматизаторов. Применяется как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Зарегистрирован в качестве пищевой добавки E1510.
В США «Энергетический Билль», подписанный Президентом Бушем в августе 2005 года предусматривает производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 миллиард литров из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности).
Строительство завода по производству этанола мощностью 40 млн галлонов даёт экономике (на примере США):
- 142 млн долл. инвестиций во время строительства;
- 41 рабочее место на заводе, плюс 694 рабочих места во всей экономике;
- Увеличивает местные цены на зерновые на 5—10 центов за бушель ;
- Увеличивает доходы местных домохозяйств на 19,6 млн долл. ежегодно;
- Приносит в среднем 1,2 млн долл. налогов;
- Доходность инвестиций 13,3 % годовых;
В 2006 г. этаноловая индустрия дала экономике США:
- 160231 новых рабочих мест во всех секторах, включая 20000 рабочих мест в строительстве;
- Увеличила доходы домохозяйств на $6,7 миллиарда;
- Принесла $2,7 млрд федеральных налогов и $2,3 млрд местных налогов;
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей кукурузы, что составляет 20,5 % годового производства кукурузы. Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая соргоСША.
В 2006 году этаноловая промышленность произвела 12 млн тонн кормов. 75—80 % зерна было скормлено КРС, 18—20 % свиньям и 3—5 % птицам.
Производство барды этаноловой промышленностью США, метрических тонн в сухом весе.
| 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2020 прогноз |
|---|---|---|---|---|---|---|---|---|
| 2,3 млн. | 2,7 млн. | 3,1 млн | 3,6 млн. | 5,8 млн. | 7,3 млн. | 9,0 млн. | 12 млн. | 20 млн. |
В 2005 году 30 % бензина в США продавалось в смеси с этанолом. В 2006 г. этанол производили 110 заводов в 19 штатах. Производство достигло рекордного уровня в 18,52 млрд литров, что на 25 % больше, чем в 2005 году. С 2000 г. производство этанола выросло более чем на 300 %.
За 2006 год было построено 15 новых заводов. Суммарная мощность новых заводов 3 990 млрд литров. В январе 2007 г. различных стадиях строительства находятся 73 завода, 8 заводов расширяют свои мощности. К 2009 году производство этанола в США вырастет более чем на 23 млрд литров — до 44 млрд.
В 2005 году этанол составил около 20 % в топливном балансе Бразилии.
Этанол хорошо смешивается с водой, в отличие от бензина. Проблема расслаивания смеси бензина и этанола на данный момент не решена.
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 — означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине и на Е85. Такие автомобили называются «Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживают использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели 2006 г. в США эксплуатировалось 6 млн автомобилей с Flex-Fuel двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность
Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 г.) делает его использование экономически выгодным [1].
Биоэтанол как топливо нейтрален в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было связано из атмосферы использованными для его производства растениями.
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в СО2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей.
Мировое производство этанола
Производство этанола по странам, млн литров. Данные ethanolrfa.org.
| Страна | 2004 | 2005 | 2006 | 2007 | 2008 |
|---|---|---|---|---|---|
| США | 13 362 | 16 117 | 19 946 | 24564,71 | 34776 [3] |
| Бразилия | 15 078 | 15 978 | 16 977 | 18972,58 | 24464,9 |
| Евросоюз | – | – | – | 2155,73 | 2773 |
| Китай | 3 643 | 3 795 | 3 845 | 1837,08 | 1897,18 |
| Индия | 1 746 | 1 697 | 1 897 | 199,58 | 249,48 |
| Франция | 827 | 907 | 948 | – | – |
| Германия | 268 | 430 | 764 | – | – |
| Россия | 748 | 748 | 649 | – | – |
| ЮАР | 415 | 389 | 387 | – | – |
| Великобритания | 400 | 351 | 279 | – | – |
| Испания | 298 | 298 | 463 | – | – |
| Таиланд | 279 | 298 | 352 | 299,37 | 339,4 |
| Колумбия | – | – | 279 | 283,12 | 299,37 |
| Весь мир : | 40 710 | 45 927 | 50 989 | 49524,42 [4] | 65527,05 |
Безопасность и регулирование
- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- Этиловый спирт относится к наркотическим ядам. [7] Употребление спиртных напитков может привести к алкоголизму и даже к острому отравлению .
- В настоящее время (2009 г) розничная продажа спирта в России запрещена.
О налогообложении питьевого спирта см. статью Алкогольные напитки#Акциз .
В зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия этанол может обладать наркотическим и токсическим действием. Однако этанол является естественным метаболитом человеческого организма, и в определённых дозах используется в медицине как самостоятельное лекарственное средство, а также как растворитель фармацевтических препаратов, экстрактов и настоек.
Хроническое употребление алкогольных напитков может привести к алкоголизму.
Органическая химия. Спирты.
Этиловый спирт или винный является широко распространённым представителем спиртов. Известно много веществ, в состав которых наряду с углеродом и водородом входит кислород. Из числа кислородсодержащих соединений мне интересен прежде всего класс спиртов.
Этиловый спирт
Физические свойства спирта . Этиловый спирт С2Н6О — бесцветная жидкость со своеобразным запахом, легче воды (удельный вес 0,8), кипит при температуре 78°,3, хорошо растворяет многие неорганические и органические вещества. Спирт «ректификат» содержит 96% этилового спирта и 4% воды.
Строение молекулы спирта . Согласно валентности элементов, формуле С2Н6О соответствуют две структуры:

 Чтобы решить вопрос о том, какая из формул соответствует спирту в действительности, обратимся к опыту.
Чтобы решить вопрос о том, какая из формул соответствует спирту в действительности, обратимся к опыту.
Поместим в пробирку со спиртом кусочек натрия. Тотчас начнётся реакция, сопровождающаяся выделением газа. Нетрудно установить, что этот газ — водород.
Теперь поставим опыт так, чтобы можно было определить, сколько атомов водорода выделяется при реакции из каждой молекулы спирта. Для этого в колбу с мелкими кусочками натрия (рис. 1) прибавим по каплям из воронки определённое количество спирта, например 0,1 грамм-молекулы (4,6 грамма). Выделяющийся из спирта водород вытесняет воду из двугорлой склянки в измерительный цилиндр. Объём вытесненной воды в цилиндре соответствует объёму выделившегося водорода.

Рис.1. Количественный опыт получения водорода из этилового спирта.
Так как для опыта была взята 0,1 грамм-молекулы спирта, то водорода удаётся получить (в пересчёте на нормальные условия) около 1,12 литра. Это означает, что из грамм-молекулы спирта натрий вытесняет 11,2 литра, т.е. половину грамм-молекулы, иначе говоря 1 грамм-атом водорода. Следовательно, из каждой молекулы спирта натрием вытесняется только один атом водорода.
Очевидно, в молекуле спирта этот атом водорода находится в особом положении по сравнению с остальными пятью атомами водорода. Формула (1) не даёт объяснения такому факту. Согласно ей, все атомы водорода одинаково связаны с атомами углерода и, как нам известно, не вытесняются металлическим натрием (натрий хранят в смеси углеводородов — в керосине). Наоборот, формула (2) отражает наличие одного атома, находящегося в особом положении: он соединён с углеродом через атом кислорода. Можно заключить, что именно этот атом водорода связан с атомом кислорода менее прочно; он оказывается более подвижным и вытесняется натрием. Следовательно, структурная формула этилового спирта:

Несмотря на большую подвижность атома водорода гидроксильной группы по сравнению с другими атомами водорода, этиловый спирт не является электролитом и в водном растворе не диссоциирует на ионы.
Связи между атомами в молекуле этилового спирта ковалентные:

Чтобы подчеркнуть, что в молекуле спирта содержится гидроксильная группа — ОН, соединённая с углеводородным радикалом, молекулярную формулу этилового спирта пишут так:

Химические свойства спирта . Выше мы видели, что этиловый спирт реагирует с натрием. Зная строение спирта, мы можем эту реакцию выразить уравнением:

Продукт замещения водорода в спирте натрием носит название этилата натрия. Он может быть выделен после реакции (путём испарения избытка спирта) в виде твёрдого вещества.
При поджигании на воздухе спирт горит синеватым, еле заметным пламенем, выделяя много тепла:

Если в колбе с холодильником нагревать этиловый спирт с галогеноводородной кислотой, например с НВг (или смесью NаВг и Н2SО4, дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость — бромистый этил С2Н5Вг:

Эта реакция подтверждает наличие гидроксильной группы в молекуле спирта.
При нагревании с концентрированной серной кислотой в качестве катализатора спирт легко дегидратируется, т. е. отщепляет воду (приставка «де» указывает на отделение чего-либо):

Эта реакция используется для получения этилена в лаборатории. При более слабом нагревании спирта с серной кислотой (не выше 140°) каждая молекула воды отщепляется от двух молекул спирта, вследствие чего образуется диэтиловый эфир — летучая легко воспламеняющаяся жидкость:

Диэтиловый эфир (иногда называемый серным эфиром) применяется в качестве растворителя (чистка тканей) и в медицине для наркоза. Он относится к классу простых эфиров — органических веществ, молекулы которых состоят из двух углеводородных радикалов, соединённых посредством атома кислорода: R — О — R1
Применение этилового спирта . Этиловый спирт имеет большое практическое значение. Много этилового спирта расходуется на получение синтетического каучука по способу академика С. В. Лебедева. Пропуская пары этилового спирта через специальный катализатор, получают дивинил:

который затем может полимеризоваться в каучук.
Спирт идёт на выработку красителей, диэтилового эфира, различных «фруктовых эссенций» и ряда других органических веществ. Спирт как растворитель применяется для изготовления парфюмерных продуктов, многих лекарств. Растворяя в спирте смолы, готовят различные лаки. Высокая теплотворная способность спирта обусловливает применение его в качестве горючего (автомобильного топлива = этанола).
Получение этилового спирта . Мировое производство спирта измеряется миллионами тонн в год.
Распространённым способом получения спирта является брожение сахаристых веществ в присутствии дрожжей. В этих низших растительных организмах (грибках) вырабатываются особые вещества — ферменты, которые служат биологическими катализаторами реакции брожения.
В качестве исходных материалов в производстве спирта берут семена злаков или клубни картофеля, богатые крахмалом. Крахмал с помощью солода, содержащего фермент диастаз, сперва превращают в сахар, который затем сбраживают в спирт.
Учёные много работали над тем, чтобы заменить пищевое сырьё для получения спирта более дешёвым непищевым сырьём. Эти поиски увенчались успехом. Сейчас широко развито промышленное получение спирта из отходов древесины. Древесина, как и крахмал, превращается в сахар, а из сахара получают спирт.
В последнее время в связи с тем, что при крекинге нефти образуется много этилена, стали получать спирт путём гидратации этилена в присутствии катализаторов:
Реакция гидратации этилена (в присутствии серной кислоты) была изучена ещё А. М. Бутлеровым и В. Горяиновым (1873), который предсказал и её промышленное значение. Разработан и внедрен в промышленность также метод прямой гидратации этилена пропусканием его в смеси с парами воды над твердыми катализаторами. Получение спирта из этилена очень экономично, так как этилен входит в состав газов крекинга нефти и других промышленных газов и, следовательно, является широкодоступным сырьем.
Другой способ основан на использовании в качестве исходного продукта ацетилена. Ацетилен подвергается гидратации по реакции Кучерова, а образующийся уксусный альдегид каталитически восстанавливают водородом в присутствии никеля в этиловый спирт. Весь процесс гидратации ацетилена с последующим восстановлением водородом на никелевом катализаторе в этиловый спирт может быть представлен схемой.

Гомологический ряд спиртов
Кроме этилового спирта, известны и другие спирты, сходные с ним по строению и свойствам. Все они могут рассматриваться как производные соответствующих предельных углеводородов, в молекулах которых один атом водорода заменён гидроксильной группой:
Температура кипения спиртов в º С
Будучи сходны по химическим свойствам и отличаясь друг от друга по составу молекул на группу атомов СН2, эти спирты составляют гомологический ряд. Сравнивая физические свойства спиртов, мы в этом ряду, так же как и в ряду углеводородов, наблюдаем переход количественных изменений в изменения качественные. Общая формула спиртов данного ряда R — ОН (где R — углеводородный радикал).
Известны спирты, в молекулы которых входит несколько гидроксильных групп, например:

Группы атомов, обусловливающие характерные химические свойства соединений, т. е. их химическую функцию, называются функциональными группами.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединённых с углеводородным радикалом .
По своему составу спирты отличаются от углеводородов, соответствующих им по числу углеродных атомов, наличием кислорода (например, С2Н6 и С2Н6О или С2Н5ОН). Поэтому спирты можно рассматривать как продукты частичного окисления углеводородов.
Генетическая связь между углеводородами и спиртами
Произвести непосредственное окисление углеводорода в спирт довольно трудно. Практически проще это сделать через галогенопроизводное углеводорода. Например, чтобы получить этиловый спирт, исходя из этана С2Н6, можно сначала получить бромистый этил по реакции:

а затем бромистый этил превратить в спирт нагреванием с водой в присутствии щёлочи:

Щёлочь при этом нужна, чтобы нейтрализовать образующийся бромистый водород и устранить возможность реакции его со спиртом, т.е. сдвинуть эту обратимую реакцию вправо.
Подобным же образом метиловый спирт может быть получен по схеме:

Таким образом, углеводороды, их галогенопроизводные и спирты находятся между собой в генетической связи (связи по происхождению).
К какому классу относится этанол
ГОСТ Р 51999-2002
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СПИРТ ЭТИЛОВЫЙ ТЕХНИЧЕСКИЙ СИНТЕТИЧЕСКИЙ РЕКТИФИКОВАННЫЙ И ДЕНАТУРИРОВАННЫЙ
Technical rectified and denatured synthetic ethyl alcohol. Specifications
ОКС 71.080.60
ОКП 24 2101
Дата введения 2004-01-01
Предисловие
1 РАЗРАБОТАН И ВНЕСЕН Техническим комитетом по стандартизации ТК «Биотехнологическая продукция немедицинского назначения» и Федеральным государственным унитарным предприятием «Государственный научно-исследовательский институт биосинтеза белковых веществ» (ФГУП «ГОСНИИСИНТЕЗБЕЛОК»)
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 30 декабря 2002 г. N 528-ст
3 ВВЕДЕН ВПЕРВЫЕ
4 Издание (май 2018 г.) с Изменениями N 1, N 2 (ИУС 6-2011, 2-2018)
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1 Область применения
Настоящий стандарт распространяется на ректификованный и денатурированный синтетический технический этиловый спирт (далее — спирт), предназначенный для изготовления различной химической продукции, парфюмерно-косметических изделий, для медицинской и фармацевтической продукции при производстве средств наружного применения, а также для поставки на экспорт.
Относительная молекулярная масса (по международным атомным массам 2007 г.) — 46,06.
Раздел 1. (Измененная редакция, Изм. N 1, N 2).
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.010-76 Система стандартов безопасности труда. Взрывобезопасность. Общие требования
ГОСТ 12.1.018-93 Система стандартов безопасности труда. Пожаровзрывобезопасность статического электричества. Общие требования
ГОСТ 12.1.044-89 (ИСО 4589-84) Система стандартов безопасности труда. Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 12.4.026-2015 Система стандартов безопасности труда. Цвета сигнальные, знаки безопасности и разметка сигнальная. Назначение и правила применения. Общие технические требования и характеристики. Методы испытаний
ГОСТ 12.4.121-2015 Система стандартов безопасности труда. Средства индивидуальной защиты органов дыхания. Противогазы фильтрующие. Технические условия
ГОСТ 12.4.296-2015 Система стандартов безопасности труда. Средства индивидуальной защиты органов дыхания. Респираторы фильтрующие. Общие технические условия
ГОСТ 245-76 Реактивы. Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2517-85 Нефть и нефтепродукты. Методы отбора проб
ГОСТ 3022-80 Водород технический. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3639-79 Растворы водно-спиртовые. Методы определения концентрации этилового спирта
ГОСТ 5799-78 Фляги для лакокрасочных материалов. Технические условия
ГОСТ 6016-77 Реактивы. Спирт изобутиловый. Технические условия
ГОСТ 6247-79 Бочки стальные сварные с обручами катания на корпусе. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9293-74 (ИСО 2435-73) Азот газообразный и жидкий. Технические условия
ГОСТ 13950-91 Бочки стальные сварные и закатные с гофрами на корпусе. Технические условия
ГОСТ 14870-77 Продукты химические. Методы определения воды
ГОСТ 17366-80 Бочки стальные сварные толстостенные для химических продуктов. Технические условия
ГОСТ 18995.1-73 Продукты химические жидкие. Методы определения плотности
ГОСТ 19433-88 Грузы опасные. Классификация и маркировка
ГОСТ 19908-90 Тигли, чаши, стаканы, колбы, воронки, пробирки и наконечники из прозрачного кварцевого стекла. Общие технические условия
ГОСТ 21029-75 Бочки алюминиевые для химических продуктов. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26319-84 Грузы опасные. Упаковка
ГОСТ 26663-85 Пакеты транспортные. Формирование с применением средств пакетирования. Общие технические требования
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29228-91 (ИСО 835-2-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 2. Пипетки градуированные без установленного времени ожидания
ГОСТ 30852.5-2002 (МЭК 60079-4:1975) Электрооборудование взрывозащищенное. Часть 4. Метод определения температуры самовоспламенения
ГОСТ 30852.11-2002 (МЭК 60079-12:1978) Электрооборудование взрывозащищенное. Часть 12. Классификация смесей газов и паров с воздухом по безопасным экспериментальным максимальным зазорам и минимальным воспламеняющим токам
ГОСТ 31340-2007 Предупредительная маркировка химической продукции. Общие требования
ГОСТ 31497-2012 Спирт этиловый. Спектрофотометрический метод определения содержания денатурирующих добавок (битрекса, керосина, бензина)
ГОСТ 32036-2013 Спирт этиловый из пищевого сырья. Правила приемки и методы анализа
ГОСТ Р 51330.5-99 (МЭК 60079-4-75). Электрооборудование взрывозащищенное. Часть 4. Метод определения температуры самовоспламенения
ГОСТ Р 57251-2016 Спирт этиловый технический. Правила приемки и методы анализа
Раздел 2 (Измененная редакция, Изм. N 1).
3 Технические требования
3.1 Спирт изготовляют в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке,
3.2 Характеристики
Спирт выпускают двух марок А и Б:
А — ректификованный синтетический технический этиловый спирт, получаемый химической очисткой и ректификацией водно-спиртового конденсата синтетического этилового спирта, а также технического синтетического этилового спирта, вырабатываемого прямой гидратацией этилена в присутствии катализатора;
Б — денатурированный ректификованный синтетический технический этиловый спирт, получаемый денатурацией денатониум бензоатом (битрекс) ректификованного синтетического технического этилового спирта.
(Измененная редакция, Изм. N 1).
3.2.1 По физико-химическим показателям спирт должен соответствовать требованиям и нормам, указанным в таблице 1.