Какие вещества выступают в качестве окислителя
Окисляющий агент (окислитель) – определение, примеры, викторина
Определение окисляющего агента
Окислитель – это химическое вещество, которое вызывает другое химическое вещество. вид потерять электроны. Окисление означает потерю электронов, потерю атома водорода или добавление атома кислорода. Окислитель обладает способностью принимать или переносить эти электроны.
Обзор окислителя
Окислитель можно сравнить с восстановителем или химическим веществом, вызывающим другое молекула получить электроны. Агент, способный окислять другой вид, заставляет его терять электроны. Альтернативно, окислителем может быть добавление кислорода к химическому виду. Кислород оттягивает электроны от других частей молекулы, эффективно окисляя всю молекулу. В других случаях, как мы увидим в примерах, окислитель отделен от восстановителя, но позволяет переносу электронов завершить реакцию восстановления-окисления или окислительно-восстановительную реакцию для краткости.
Окислительно-восстановительные реакции всегда состоят из двух полуреакций, независимо от того, происходят ли они вместе. Реакция восстановления происходит, когда химическое вещество приобретает электроны. Эти электроны должны прийти откуда-то и потеряться из другого химического вида в предыдущем процессе. Этот процесс известен как окисление. Окислитель или окислитель отвечает за удаление этих электронов. Агент может быть непосредственно вовлечен в реакцию или может быть катализатором, который просто приводит к удалению электронов из вещества.
Список окислителей
Окисляющим агентом может быть любая химическая разновидность, которая склонна принимать электроны. Поэтому такие вещества, как кислоты, обычно являются окислителями из-за их склонности поглощать больше электронов. Ниже приведены несколько распространенных окислителей:
- кислород
- Фтор
- хлор
- Азотная кислота
- Пероксид водорода
- И МНОГОЕ БОЛЬШЕ …
Примеры окисляющих агентов
Формирование соли в лаборатории
Поваренная соль – это чрезвычайно простая комбинация двух элементов: натрия и хлора. В то время как большая часть соли, произведенной в промышленных масштабах, производится путем извлечения предварительно приготовленной соли из природы, она может быть сделано в лаборатории, При объединении твердого металлического натрия в атмосфере газообразного хлора натрий окисляется. Эта реакция окисления сочетается с реакцией восстановления хлора. Другими словами, натрий теряет электрон, превращаясь в катион натрия (положительный ион). Хлор получает электрон, становясь отрицательным анионом. Вместе эти два иона образуют ионное соединение хлорида натрия или поваренной соли. Интересно, что хотя поваренная соль в основном безвредна, газообразный хлор является чрезвычайно токсичным соединением.
Частично причина, по которой газообразный хлор настолько смертоносен, заключается в том, что он является чрезвычайно мощным окислителем. Хлор обладает высокой реакционной способностью и, как правило, пытается отвести электроны. Хотя окисление может превратить металл в соль, оно может также опасно реагировать на многочисленные химические реакции организма, откачивая столь необходимые электроны и вызывая хаос. К счастью, окислители работают только в одном направлении. Вам не нужно беспокоиться о том, что вас отравят поваренной солью.
Фруктовая батарея
Другой интересный окислитель представлен в виде классической демонстрации в классе. Фруктовая батарея, также известная как лимонная или картофельная батарея является формой электрического тока, вызванного окислительно-восстановительными реакциями. Два зонда размещены по обе стороны от лимона или другого фрукта или овоща. Один зонд, изготовленный из цинка, соединен через осветительный прибор с другим зондом из меди.
Цинковый зонд в присутствии кислотности плода начинает растворяться в плодах. Это происходит благодаря окислению кислот в плодах. Кислота действует как катализатор, который позволяет некоторым атомам цинка терять свои связи с другим цинком, оставляя позади электроны, которые удерживают их в матрице. Электроны, которые сейчас накапливаются в цинковом зонде, стараются равномерно распределиться вдоль зонда. Между тем, на медном зонде медь действует как катализатор в восстановлении ионов водорода в газообразный водород. Медь откладывает избыточные электроны на ионы водорода, которые затем могут образовывать ковалентные связи друг с другом. Это создает маленькие пузырьки вокруг медного зонда.
Таким образом, на одной стороне фруктовой батареи существует потребность в электронах, а на другой – избыток электронов. Медный провод, соединяющий два датчика через свет, действует как проводник, обеспечивая легкий путь для прохождения электронов. Когда электроны текут от цинка к меди, они могут высвобождать часть своей энергии в лампочку и создавать свет. Описанные выше концепции можно увидеть на изображении ниже, которое представляет собой диаграмму любой простой батареи. Фруктовая батарея, хотя некоторые ошибочно утверждают, что она питается живыми фруктами, функционирует как все батареи.

Окислительного фосфорилирования
Одним из наиболее важных биохимических процессов для всех живых животных является окислительного фосфорилирования , или передача электронов от питательных веществ к молекулам, которые обеспечивают энергию для клеток. Как правило, полный распад пищи представляет собой серию окислительно-восстановительных реакций, которые имеют много различных окислителей и получателей электронов. Окислительное фосфорилирование является последней стадией процесса и происходит в митохондрии всех растений и животных.
Во время окислительного фосфорилирования, ряд белков, встроенных в митохондриальную мембрану, катализирует реакции окисления и направляет электроны к другим белкам. Эти белки катализируют реакции восстановления АТФ и других энергоносителей. Эта сложная серия окислительно-восстановительных реакций использует много белков, но работает почти так же, как батарея. Однако вместо того, чтобы выделять энергию в форме света, энергия в основном задерживается при образовании новых связей. Часть энергии выделяется в виде тепла, поэтому митохондрии значительно более горячие, чем остальная часть клетки.
ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ В ХИМИЧЕСКИХ РЕАКЦИЯХ

Окислители и восстановители в химии — интересный, но очень часто вызывающий затруднения, вопрос.
Окислители и восстановители являются главными участниками особого типа химических процессов, к которым можно отнести большинство реакций, встречаемых нами и в природе, и в технике. Это окислительно-восстановительные реакции (ОВР) .
К примеру, превращение с помощью нитрифицирующих бактерий атмосферного азота в легко усваиваемую растениями форму, фотосинтез, дыхание живых организмов (от бактерий до высших растений и животных) — это ОВР в природе.
А вот выплавка стали, промышленное получение аммиака из азота и водорода, гальванические процессы, электролиз – эти и огромное количество других процессов являются примерами ОВР в технике.
Так что же такое окислительно-восстановительные реакции (процессы)?
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ОВР) – это процессы, в ходе которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление сопровождают друг друга. Один процесс без другого просто не существует. Почему?
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает закон сохранения материи.
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Частица, передающая свои электроны, является восстановителем .
Переход электронов принято показывать с помощью полуреакций:

Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
А вот восстановление , по сути, противоположно окислению. В его основе – принятие электронов одной частицей от другой.
Частица, принимающая электроны, является окислителем.
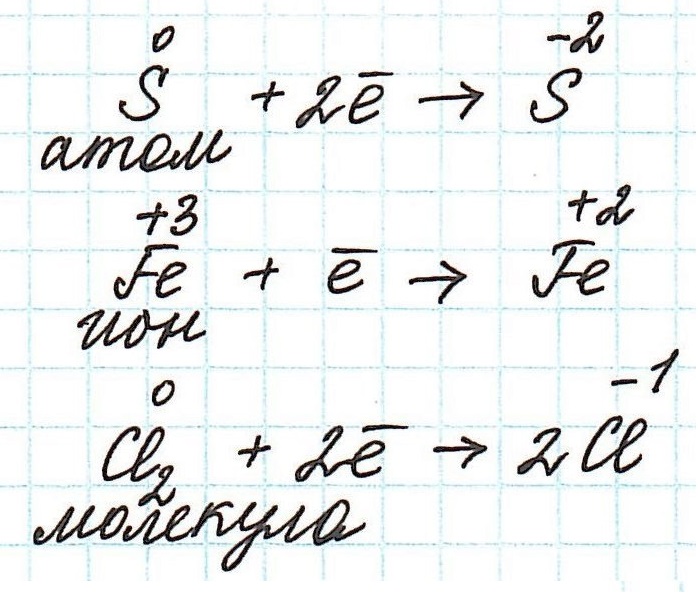
Восстановление всегда сопровождается уменьшением степени окисления!
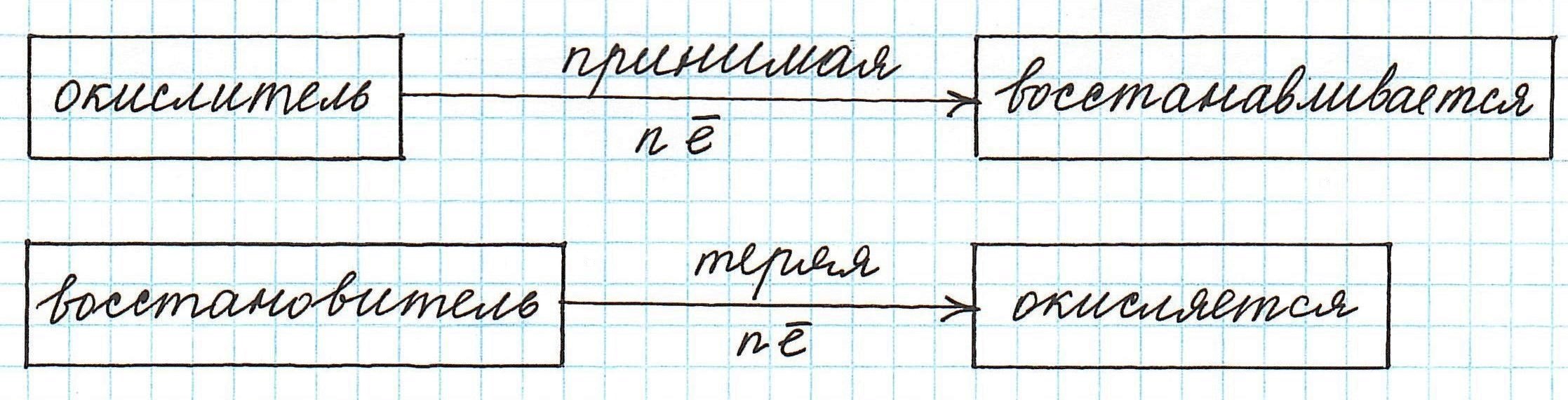
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к периодической таблице химических элементов.
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:

То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
- количество энергетических уровней остается постоянным (так, у элементов III периода их три);
- число электронов внешнего уровня растет (например, от 1 электрона у натрия и до 7 электронов у хлора).
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:

3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:

Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:

Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения: Значения восстановительных стандартных потенциалов фтора и лития таковы:
Значения восстановительных стандартных потенциалов фтора и лития таковы:
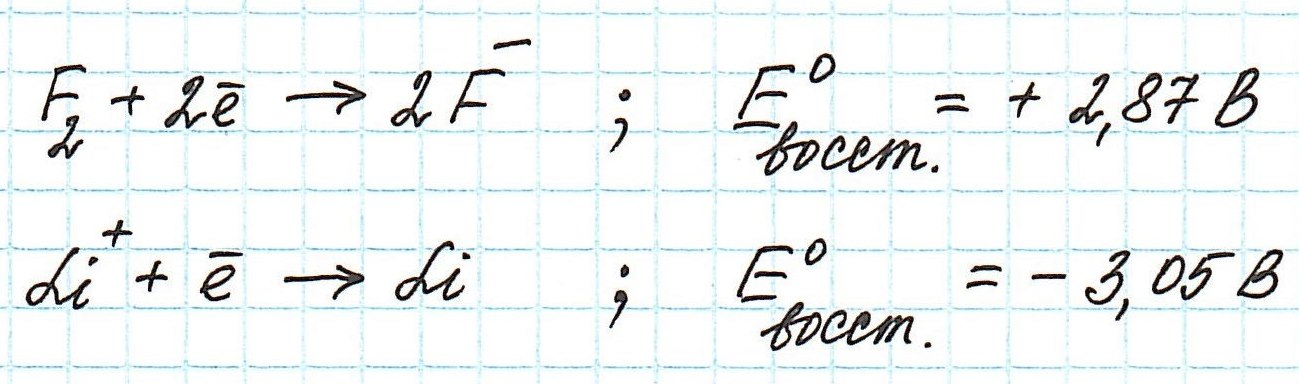 Анализируя эти полуреакции и значения восстановительных потенциалов, приходим к выводу, что сильнее других окисляют атомы фтора: они, восстанавливаясь, легче других принимают электроны. А ионы лития восстанавливаются с большим трудом.
Анализируя эти полуреакции и значения восстановительных потенциалов, приходим к выводу, что сильнее других окисляют атомы фтора: они, восстанавливаясь, легче других принимают электроны. А ионы лития восстанавливаются с большим трудом.
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
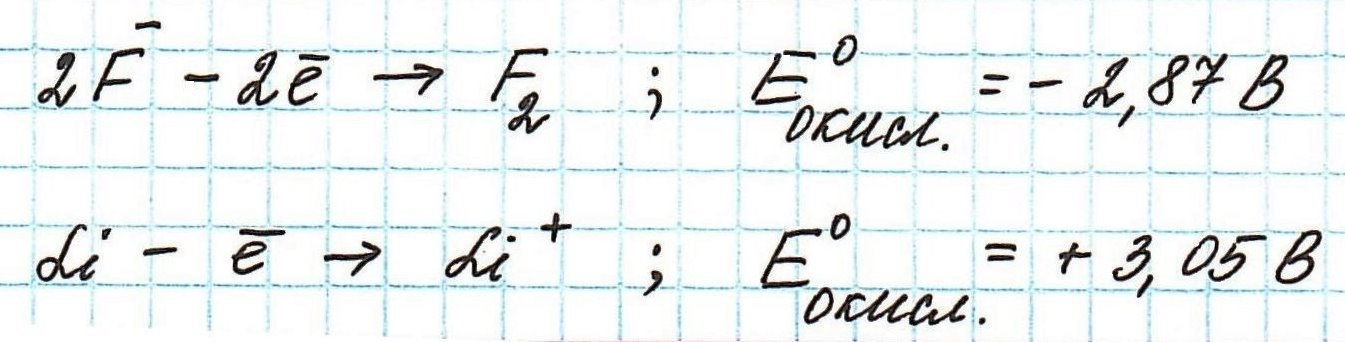 А говорить они будут о том, что ион фтора окисляется с очень большим трудом, а атом лития, наоборот, легко превращается при окислении в ион.
А говорить они будут о том, что ион фтора окисляется с очень большим трудом, а атом лития, наоборот, легко превращается при окислении в ион.
Пример . Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
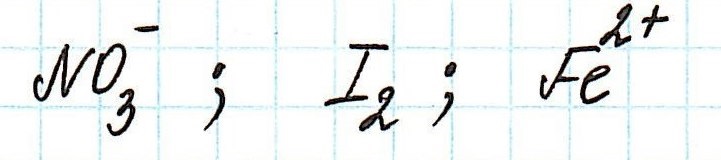 Решение:
Решение:
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.

Сравним значения восстановительных потенциалов:

Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Основные окислители и восстановители в химии
В технике применяется огромное количество окислителей и восстановителей с разной окислительной и восстановительной способностью.
Важнейшие из них представлены в таблице:

Итак, окисление и восстановление – два взаимосвязанных процесса. Они широко представлены в природе и играют огромную роль в промышленных производствах. Окислители и восстановители очень разнообразны. Чем будет являться частица (или вещество, в состав которого она входит): окислителем или восстановителем, – можно определить, используя некоторые закономерности.
Окислители и восстановители
Окислителями называют соединения или простые вещества,  которые в процессе химической реакции присоединяют к себе электроны.
которые в процессе химической реакции присоединяют к себе электроны.
Восстановителями называют соединения или простые вещества, отдающие свои электроны.
Окислительные и восстановительные реакции идут параллельно, так что количество отсоединенных и присоединенных электронов одинаково. При этом окислитель восстанавливается, а восстановитель — окисляется.
Окислителем или восстановителем могут быть атом, ион и вещества:
- простые или сложные;
- неорганические или органические;
- газ, жидкость, твердое (расплав).
Окислительное число
В химии существует такое понятие, как степень окисления, также называемое окислительным числом. Это условная величина, она оценивает активность атома при окислении или восстановлении. Эта величина используется для описания свойств соединений или ионов, помогает правильно написать уравнение хим. реакции, составить формулу вещества. Она применяется для указания количества передаваемых или принимаемых электронов.
 |
 |
 |
| Йод кристаллический | Марганец двуокись 80% (45 мкр) | Калий двухромовокислый «Ч» |
Обращая внимание на окислительное число, нужно помнить, что это не заряд атома!
Окислительное число определяется по числу электронов, которые нужно добавить иону с положительным зарядом, чтобы атом стал нейтральным, или числу электронов, которые нужно отнять у иона с отрицательным зарядом, чтобы он стал нейтральным.
Самое большое окислительное число +7. Ион +7 проявляет исключительно сильные окислительные свойства и нуждается в семи электронах, чтобы стать нейтральным. Пример вещества с окислительным числом +7 — марганец в перманганате калия.
Наименьшее окислительное число -8. Такой ион проявляет только восстановительные свойства и должен отсоединить восемь электронов, чтобы стать нейтральным.
Окислительное число на письме указывают числовым индексом со знаком над символом элемента. Для того, чтобы не перепутать степень окисления с зарядом, у окислительного числа знак ставится перед числом, а у заряда — после. Кроме этого, заряд ставится не над элементом, а в правом верхнем углу:
(NH 4 )2SO 4 — формула вещества с окислительными числами элементов;
(NH_4^(1+)) 2 SO_4^(2-) — формула вещества с указанием зарядов ионов.
К популярным окислителям относятся кислород и озон, галогены (F, Br, Cl, I), пероксиды, гипохлориты, хлораты, азотная, серная и селеновая кислота, «царская водка», хром (VI), дихромат калия, перманганаты, атомарный водород, фториды, оксиды и хлориды неметаллов и переходных металлов.
Сильные восстановители это щелочные и щелочноземельные металлы, углерод, кремний, аммиак, аммиачные растворы щелочных и щелочноземельных металлов, гидриды металлов, молекулярный водород.
Существует множество веществ, обладающих свойствами и окислителя, и восстановителя. Они содержат молекулы со средними значениями окислительного числа; могут и отсоединять, и присоединять электроны. Будут они отдавать или принимать электроны — зависит от того, с чем взаимодействуют, например, вода при контакте со фтором восстановитель, а с железом — окислитель.
- для выделения металлов из сульфидных руд;
- при очистке металлов и сплавов от примесей;
- в химпроме в органических и неорганических синтезах;
- при сжигании органического топлива;
- для производства жидкого ракетного топлива и взрывчатых веществ;
- в процессах отбеливания натуральных нитей и тканей, целлюлозы, бумаги;
- для травления металлов;
- для изготовления катодов химических источников тока.
Восстановители востребованы: 
- в металлургии для получения железа из руды;
- при металлотермическом производстве цветных металлов;
- для выделения цветных металлов из водных солевых растворов;
- при получении металлов и их соединений из газов;
- в различных химических реакциях, в органическом синтезе;
- в фотоделе в качестве проявителей;
- для изготовления анодов химических источников тока.
Окислитель
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
- Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
Содержание
- 1 Распространённые окислители и их продукты
- 2 Мнемонические правила
- 3 Зависимость степени окисления от концентрации окислителя
- 4 Сильные окислители
- 5 Очень сильные окислители
- 6 См. также
Распространённые окислители и их продукты [ править ]
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2 кислород |  |
Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) |
+0,401 (в щелочной среде)

с активными металлами, концентрированная

с тяжёлыми металлами, разбавленная

c тяжёлыми металлами, концентрированная


с активными металлами


SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы




Мнемонические правила [ править ]
Для запоминания свойств окислителей и восстановителей существует несколько мнемонических правил:
- Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
- Ассоциация со знакомым словом: ПВО — Присоединяет (электроны), Восстанавливается, является Окислителем.
- Отдает — окисляется, сам восстановителем является.
Зависимость степени окисления от концентрации окислителя [ править ]
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление. В качестве примера — реакция азотной кислоты с цинком:
Сильные окислители [ править ]
Сильными окислительными свойствами обладает «царская водка» — смесь одного объема азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе. Царская водка окисляет даже благородные металлы — золото и платину.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
Очень сильные окислители [ править ]
Условно к «очень сильным окислителям» относят вещества, превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, оксид меди(III), фторид серебра(ІІ), катионная форма Ag 2+ , все фториды ксенона, озонид цезия, надпероксид цезия, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
Типичные окислители
4. Кислородсодержащие соединение галогенов (а также их соли) являются окислителями в кислотной среде:
- HCl +1 O
- HCl +3 O2
- HCl +5 O3
- HBr +5 O3
- HCl +7 O4
- 2HI +5 O3
5. Сильные кислоты-окислители:
- Азотная кислота HNO3
- Азотистая кислота HNO2 (нитриты, нитраты);
- Серная кислота H2SO4.
Наиболее важные вещества-окислители:
- Галогены, гипохлораты, хлораты, перхлораты
- Соединения марганца: Mn2O7(VII), MnO3(VI), MnO2(IV), K2MnO4
- CrO3(VI), K2CrO4, K2CrO7
- HNO3 и ее соли
- H2SO4(конц), H2SeO4
- O2, O3, H2O2 и его соли
- CuO(II), Ag2O(I), PbO2(IV)
- Катионы благородных металлов
- Ацетат свинца (II)
- Pb(CH3COO)2, FeCl3(III), (NH4)2S2O8, K3[Fe(CN)6]
- Царская водка
- Анод при электролизе
Рассмотрим вкратце наиболее типичные и важные окислители.
Окислительные свойства хлора нашли широкое применение в трикотажной и целлюлозно-бумажной промышленности (отбеливание тканей и бумаги), в качестве дезинфицирующего средства, для обеззараживания воды. Хлор является исходным сырьем для получения многих окислителей (гипохлоритов, хлоритов, хлорпроизводных органических веществ). Уникальность хлора заключается в том, что, восстанавливаясь, хлор принимает один электрон, и переходит в хлорид-ион, который, в зависимости от условий, может терять от 1 до 8 электронов, благодаря чему хлор может принимать степень окисления от -1 до +7. Из соединений хлора, в которых он имеет максимальную степень окисления, получают соединения с промежуточными степенями окисления (в зависимости от температуры и активности восстановителя):
- KCl +7 O4 — проявляет только окислительные свойства
- KCl +5 O3
- Ba(Cl +3 )2)2
- NaCl +1 O
- Cl2 0
- HCl -1 — проявляет только свойства восстановителя
Азотная кислота является сильным окислителем, в зависимости от ее концентрации и активности восстановителя, HNO3 может восстанавливаться до различных соединений (чем концентрирована кислота, тем сильнее она восстанавливается), в которых степень окисления азота колеблется от +4 до -3:
- HN +5 O3
- N +4 O2 — до оксида азота (IV) восстанавливается концентрированная азотная кислота в реакциях с медь, свинец, бромиды;
- HN +3 O2
- N +2 O — до оксида азота (II) восстанавливается концентрированная азотная кислота в реакциях с более сильными восстановителями (цинк, магний, йодид калия);
- N2 +1 O — до оксида азота (I) восстанавливается разбавленная азотная кислота;
- N2 0 — до аммиака восстанавливается сильно разбавленная азотная кислота;
- N -1 H2OH
- N2 -2 H4
- N -3 H3
Концентрированный водный раствор азотной кислоты пассивирует алюминий, железо, хром.
Платина, золото, цирконий, торий не растворяются в азотной кислоте, но растворяются в царской водке (смесь концентрированных HCl и HNO3 в соотношении 3:1).
Высокие окислительные способности царской водки обусловлены выделяющимся атомарным хлором:
Растворение золота происходит с образованием золотохлористоводородной кислоты:
Суммарное уравнение окисления золота царской водкой:
Тантал, ниобий, вольфрам, молибден не растворяются даже в царской водке, для их растворения используют смесь азотной и фтороводородной кислоты.
Напоследок скажем о кислороде, который является, пожалуй, самым распространенным окислителем на Земле.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе